2021高考真题汇编-化学反应中的能量变化
试卷更新日期:2021-06-17 类型:二轮复习
一、单选题
-
1. 常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为 。下列说法错误的是( )A、产生22.4L(标准状况) 时,反应中转移 B、反应中氧化剂和还原剂的物质的量之比为11:6 C、可用石灰乳吸收反应产生的 制备漂白粉 D、可用酸化的淀粉碘化钾溶液检验食盐中 的存在2. 锌溴液流电池是一种先进的水溶液电解质电池,广泛应用于再生能源储能和智能电网的备用电源等。三单体串联锌溴液流电池工作原理如图所:
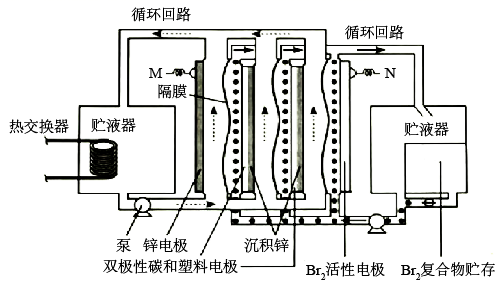
下列说法错误的是( )
A、放电时,N极为正极 B、放电时,左侧贮液器中 的浓度不断减小 C、充电时,M极的电极反应式为 D、隔膜允许阳离子通过,也允许阴离子通过3. 关于非金属含氧酸及其盐的性质,下列说法正确的是( )A、浓H2SO4具有强吸水性,能吸收糖类化合物中的水分并使其炭化 B、NaClO、KClO3等氯的含氧酸盐的氧化性会随溶液的pH减小而增强 C、加热NaI与浓H3PO4混合物可制备HI,说明H3PO4比HI酸性强 D、浓HNO3和稀HNO3与Cu反应的还原产物分别为NO2和NO,故稀HNO3氧化性更强4. K—O2电池结构如图,a和b为两个电极,其中之一为单质钾片。关于该电池,下列说法错误的是( ) A、隔膜允许K+通过,不允许O2通过 B、放电时,电流由b电极沿导线流向a电极;充电时,b电极为阳极 C、产生1Ah电量时,生成KO2的质量与消耗O2的质量比值约为2.22 D、用此电池为铅酸蓄电池充电,消耗3.9g钾时,铅酸蓄电池消耗0.9g水5. 沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排故并 降低冷却效率。为解决这一问题,通常在管道口设置一对情性电极(如图所示),通入一定的电流。
A、隔膜允许K+通过,不允许O2通过 B、放电时,电流由b电极沿导线流向a电极;充电时,b电极为阳极 C、产生1Ah电量时,生成KO2的质量与消耗O2的质量比值约为2.22 D、用此电池为铅酸蓄电池充电,消耗3.9g钾时,铅酸蓄电池消耗0.9g水5. 沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排故并 降低冷却效率。为解决这一问题,通常在管道口设置一对情性电极(如图所示),通入一定的电流。下列叙述错误的是( )
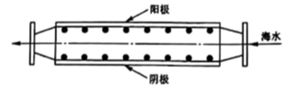 A、阳极发生将海水中的 氧化生成 的反应 B、管道中可以生成氧化灭杀附着生物的NaClO C、阴极生成的 应及时通风稀释安全地排入大气 D、阳极表面形成的Mg 等积垢需要定期清理6. 已知共价键的键能与热化学方程式信息如下表:
A、阳极发生将海水中的 氧化生成 的反应 B、管道中可以生成氧化灭杀附着生物的NaClO C、阴极生成的 应及时通风稀释安全地排入大气 D、阳极表面形成的Mg 等积垢需要定期清理6. 已知共价键的键能与热化学方程式信息如下表:共价键
H- H
H-O
键能/(kJ·mol-1)
436
463
热化学方程式
2H2(g) + O2 (g)=2H2O(g) ΔH= -482kJ·mol-1
则2O(g)=O2(g)的ΔH为( )
A、428 kJ·mol-1 B、-428 kJ·mol-1 C、498 kJ·mol-1 D、-498 kJ·mol-17. 关于反应8NH3+6NO2=7N2+12H2O,下列说法正确的是( )A、NH3中H元素被氧化 B、NO2在反应过程中失去电子 C、还原剂与氧化剂的物质的量之比为3:4 D、氧化产物与还原产物的质量之比为4:38. 镍镉电池是二次电池,其工作原理示意图如下(L 为小灯泡,K1、K2为开关,a、b为直流电源的两极)。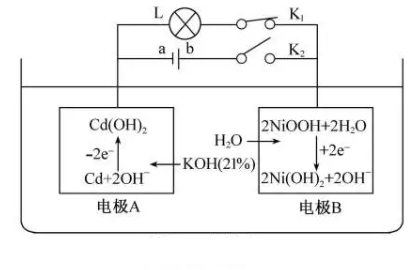
下列说法错误的是( )
A、断开K2、合上K1 , 镍镉电池能量转化形式:化学能→电能 B、断开K1、合上K2 , 电极A为阴极,发生还原反应 C、电极B发生氧化反应过程中,溶液中KOH浓度不变 D、镍镉二次电池的总反应式:Cd+ 2NiOOH+2H2O Cd(OH)2+2Ni(OH)2二、综合题
-
9. 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法I:氨热分解法制氢气
相关化学键的键能数据
化学键
键能
946
436.0
390.8
一定温度下,利用催化剂将 分解为 和 。回答下列问题:
(1)、反应 ;(2)、已知该反应的 ,在下列哪些温度下反应能自发进行?_______(填标号)A、25℃ B、125℃ C、225℃ D、325℃(3)、某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将 通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。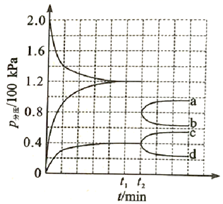
①若保持容器体积不变, 时反应达到平衡,用 的浓度变化表示 时间内的反应速率 (用含 的代数式表示)
② 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是(用图中a、b、c、d表示),理由是;
③在该温度下,反应的标准平衡常数 。(已知:分压=总压×该组分物质的量分数,对于反应 , ,其中 , 、 、 、 为各组分的平衡分压)。
方法Ⅱ:氨电解法制氢气
利用电解原理,将氮转化为高纯氢气,其装置如图所示。
 (4)、电解过程中 的移动方向为(填“从左往右”或“从右往左”);(5)、阳极的电极反应式为。
(4)、电解过程中 的移动方向为(填“从左往右”或“从右往左”);(5)、阳极的电极反应式为。KOH溶液KOH溶液
10. 当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。(1)、大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:物质
H2(g)
C(石墨,s)
C6H6(l)
燃烧热△H(kJ•mol-1)
-285.8
-393.5
-3267.5
则25℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为。
(2)、雨水中含有来自大气的CO2 , 溶于水中的CO2进一步和水反应,发生电离:①CO2(g)=CO2(aq)
②CO2(aq)+H2O(l)=H+(aq)+HCO (aq)
25℃时,反应②的平衡常数为K2。
溶液中CO2的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为ymol•L-1•kPa-1 , 当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为mol•L-1(写出表达式,考虑水的电离,忽略HCO 的电离)
(3)、105℃时,将足量的某碳酸氢盐(MHCO3)固体置于真空恒容容器中,存在如下平衡:2MHCO3(s) M2CO3(s)+H2O(g)+CO2(g)。上述反应达平衡时体系的总压为46kPa。保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于kPa。
(4)、我国科学家研究Li—CO2电池,取得了重大科研成果,回答下列问题:①Li—CO2电池中,Li为单质锂片,则该电池中的CO2在(填“正”或“负”)极发生电化学反应。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
Ⅰ.2CO2+2e-=C2O Ⅱ.C2O =CO2+CO
Ⅲ. Ⅳ.CO +2Li+=Li2CO3
②研究表明,在电解质水溶液中,CO2气体可被电化学还原。
Ⅰ.CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为。
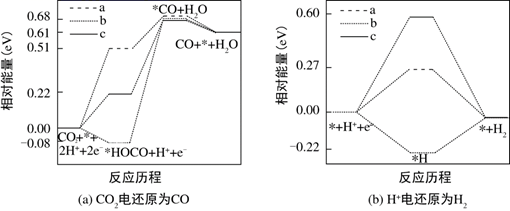
Ⅱ.在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+被还原为H2的反应可同时发生),相对能量变化如图.由此判断,CO2电还原为CO从易到难的顺序为(用a、b、c字母排序)。
 11. 氧化石墨烯具有稳定的网状结构,在能源、材料等领域有着重要的应用前景,通过氧化剥离石墨制备氧化石墨烯的一种方法如下(装置如图所示):
11. 氧化石墨烯具有稳定的网状结构,在能源、材料等领域有着重要的应用前景,通过氧化剥离石墨制备氧化石墨烯的一种方法如下(装置如图所示):
I.将浓H2SO4、NaNO3、石墨粉末在c中混合,置于冰水浴中。剧烈搅拌下,分批缓慢加入KMnO4粉末,塞好瓶口。
II.转至油浴中,35℃搅拌1小时,缓慢滴加一定量的蒸馏水。升温至98℃并保持1小时。
III.转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加H2O2至悬浊液由紫色变为土黄色。
IV.离心分离,稀盐酸洗涤沉淀。
V.蒸馏水洗涤沉淀。
VI.冷冻干燥,得到土黄色的氧化石墨烯。
回答下列问题:
(1)、装置图中,仪器a、c的名称分别是、 , 仪器b的进水口是(填字母)。(2)、步骤I中,需分批缓慢加入KMnO4粉末并使用冰水浴,原因是.(3)、步骤II中的加热方式采用油浴,不使用热水浴,原因是_.(4)、步骤III中,H2O2的作用是(以离子方程式表示).(5)、步骤IV中,洗涤是否完成,可通过检测洗出液中是否存在SO42-来判断。检测的方法是.(6)、步骤V可用pH试纸检测来判断Cl-是否洗净,其理由是.12. 磁选后的炼铁高钛炉渣,主要成分有 、 、 、MgO、CaO以及少量的 ,为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺下,有关金属离子开始沉淀和沉淀完全的pH见下表:
金属离子
开始沉淀的pH
2.2
3.5
9.5
12.4
沉淀完全(c=1.0×10*mol-L')的pH
3.2
4.7
11.1
13.8
回答下列问题:
(1)、“焙烧”中, 、 几乎不发生反应, 、MgO、CaO、 转化为相应的硫酸盐,写出 转化为 的化学方程式。(2)、“水浸”后“滤液”的pH约为2.0,在“分步沉淀”氨水逐步调节pH至11.6,依次析出的金属离子是。(3)、“母液①”中 浓度为mol·(4)、”水浸渣”在160℃“酸溶”,最适合的酸是。“酸溶渣”的成分是、。(5)、“酸溶”后,将溶液适当稀释并加热, 水解析出 沉淀,该反应的离子方程式是。(6)、将“母液①”和“母液②”混合,吸收尾气,经处理得 , 循环利用。13. 一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:(1)、历史上海藻提碘中得到一种红棕色液体,由于性质相似,Liebig误认为是ICl,从而错过了一种新元素的发现。该元素是.(2)、氯铂酸钡(BaPtCl6)固体加热时部分分解为BaCl2、Pt和Cl2 , 376.8℃时平衡常数K‘p=1.0x104Pa2。在一硬质玻璃烧瓶中加入过量BaPtCl6 , 抽真空后,通过一支管通入碘蒸气(然后将支管封闭)。在376.8℃,碘蒸气初始压强为20.0kPa.376.8℃平衡时,测得烧瓶中压强为32.5kPa,则PICl=kPa,反应2ICl(g)=Cl2(g)+I2(g)的平衡常数K=(列出计算式即可).(3)、McMorris 测定和计算了在136-180℃范围内下列反应的平衡常数KP :2NO(g)+2ICl(g) 2NOCl(g)+I2(g) KP1
2NOCl(g) 2NO(g)+Cl2(g) KP2
得到lgKP1 和lgKP2 均为线性关系,如下图所示:

①由图可知,NOCl分解为NO和Cl2反应的ΔH0(填“大于”或“小于”).
②反应2ICl(g)=Cl2(g)+I2(g)的K=(用KP1、KP2表示):该反应的ΔH0(填“大于”或“小于”),写出推理过程.
(4)、Kistiakowsky曾研究了NOCl光化学分解反应,在一定频率(v)光的照射下机理为:NOCl+hv→NOC*
NOCl+NOCl*→2NO+Cl2
其中hv表示一个光子能量,NOCl*表示NOCl的激发态。可知,分解1mol的NOCl需要吸收mol的光子。
14. “氯碱工业”以电解饱和食盐水为基础制取氯气等产品, 氯气是实验室和工业上的常用气体。请回答:(1)、电解饱和食盐水制取氯气的化学方程式是。(2)、下列说法错误的是______。A、可采用碱石灰干燥氯气 B、可通过排饱和食盐水法收集氯气 C、常温下,可通过加压使氯气液化而储存于钢瓶中 D、工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸(3)、在一定温度下,氯气溶于水的过程及其平衡常数为:Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl2(aq) + H2O(l)⇌H+ (aq)+Cl- (aq) + HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)⇌Cl2(aq)的焓变ΔH10。(填”>”、“=”或“<”)
②平衡常数K2的表达式为K2=。
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=。(用平衡压强p和上述平衡常数表示,忽略HClO的电离)
(4)、工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4 , 相应的化学方程式为;I.TiO2(s)+2Cl2(g)⇌TiCl4(g)+O2(g) ΔHI=181 mol·L-1 , KI=-3.4×10-29
II.2C(s)+O2(g)⇌2CO(g) ΔHII= - 221 mol·L-1 , KII=1.2×1048
结合数据说明氯化过程中加碳的理由 。
(5)、在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5 mol·L-1 , 反应30 min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是______。A、适当提高反应温度 B、改变催化剂 C、适当降低反应温度 D、改变反应物浓度15. 某兴趣小组用铬铁矿[Fe(CrO2)2]制备K2Cr2O7晶体,流程如下:
已知:4Fe (CrO2)2 + 10Na2CO3+7O2 8Na2CrO4 +4NaFeO2+10CO2
2H++2CrO Cr2O +H2O
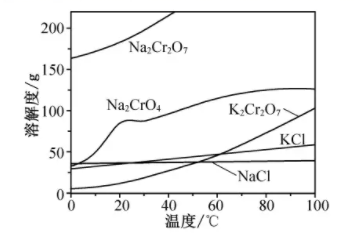
相关物质的溶解度随温度变化如下图。
请回答:
(1)、步骤I,将铬铁矿粉碎有利于加快高温氧化的速率,其理由是。(2)、下列说法正确的是______。A、步骤II,低温可提高浸取率 B、步骤II,过滤可除去NaFeO2水解产生的Fe(OH)3 C、步骤III,酸化的目的主要是使Na2CrO4转变为Na2Cr2O7 D、步骤IV,所得滤渣的主要成分是Na2SO4和Na2CO3(3)、步骤V,重结晶前,为了得到杂质较少的K2Cr2O7粗产品,从下列选项中选出合理的操作(操作不能重复使用)并排序:溶解KCl →→→→→重结晶。a.50℃蒸发溶剂;
b.100℃ 蒸发溶剂;
c.抽滤;
d.冷却至室温;
e.蒸发至溶液出现晶膜,停止加热;
f.蒸发至溶液中出现大量晶体,停止加热。
(4)、为了测定K2Cr2O7产品的纯度,可采用氧化还原滴定法。①下列关于滴定分析的操作,错误的是。
A.用量筒量取25.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
②在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,继续摇动锥形瓶,观察颜色变化。(请在横线上补全操作)
(5)、该小组用滴定法准确测得产品中K2Cr2O7的质量分数为98.50%。某同学还用分光光度法测定产品纯度(K2Cr2O7溶液的吸光度与其浓度成正比例),但测得的质量分数明显偏低。分析其原因,发现配制K2Cr2O7待测水溶液时少加了一种试剂。该试剂是 , 添加该试剂的理由是。16. 玻璃仪器内壁残留的硫单质可用热KOH溶液洗涤除去,发生如下反应:3S+6KOH 2K2S+K2SO3+3H2O
(x-1)S+K2S K2Sx(x=2~6)
S+ K2SO3 K2S2O3
请计算:
(1)、0.480 g硫单质与V mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2S和K2SO3 , 则V=。(2)、2.560 g硫单质与60.0 mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2Sx和K2S2O3 , 则x=。(写出计算过程)