2021高考真题汇编-物质结构与性质
试卷更新日期:2021-06-17 类型:二轮复习
一、单选题
-
1. 有关
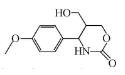 的说法错误的是( ) A、分子中至少有12个原子共平面 B、完全水解后所得有机物分子中手性碳原子数目为1个 C、与FeCl3溶液作用显紫色 D、与足量NaOH溶液完全反应后生成的钠盐只有1种
的说法错误的是( ) A、分子中至少有12个原子共平面 B、完全水解后所得有机物分子中手性碳原子数目为1个 C、与FeCl3溶液作用显紫色 D、与足量NaOH溶液完全反应后生成的钠盐只有1种二、综合题
-
2. [选修3:物质结构与性质]
硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
(1)、基态硅原子最外层的电子排布图为 , 晶体硅和碳化硅熔点较高的是(填化学式);(2)、硅和卤素单质反应可以得到 , 的熔沸点如下表:熔点/K
183.0
203.2
278.6
393.7
沸点/K
187.2
330.8
427.2
560.7
①0℃时, 、 、 、 呈液态的是(填化学式),沸点依次升高的原因是 , 气态 分子的空间构型是;
② 与N-甲基咪唑
 反应可以得到 ,其结构如图所示:
反应可以得到 ,其结构如图所示:
N-甲基咪唑分子中碳原子的杂化轨道类型为 , H、C、N的电负性由大到小的顺序为 , 1个 中含有个 键;
(3)、下图是 、 、 三种元素形成的某化合物的晶胞示意图。
①已知化合物中 和 的原子个数比为1:4,图中Z表示原子(填元素符号),该化合物的化学式为;
②已知该晶胞的晶胞参数分别为anm、bnm、cnm, ,则该晶体的密度 (设阿伏加德罗常数的值为 ,用含a、b、c、 的代数式表示)。
3. [选修3:物质结构与性质]KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
(1)、在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是(填离子符号)。(2)、原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用- 表示,称为电子的自旋磁量子数.对于基态的磷原子,其价电子自旋磁量子数的代数和为。(3)、已知有关氨、磷的单键和三键的键能(kJ•mol-1)如表:N—N
N≡N
P—P
P≡P
193
946
197
489
从能量角度看,氮以N2、而白磷以P4(结构式可表示为
 )形式存在的原因是。(4)、已知KH2PO2是次磷酸的正盐,H3PO2的结构式为 , 其中P采取杂化方式。(5)、与PO 电子总数相同的等电子体的分子式为。(6)、磷酸通过分子间脱水缩合形成多磷酸,如:
)形式存在的原因是。(4)、已知KH2PO2是次磷酸的正盐,H3PO2的结构式为 , 其中P采取杂化方式。(5)、与PO 电子总数相同的等电子体的分子式为。(6)、磷酸通过分子间脱水缩合形成多磷酸,如: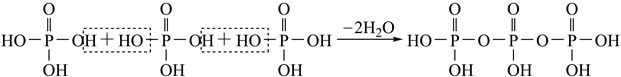 如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。(7)、分别用○、●表示H2PO 和K+ , KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO 、K+在晶胞xz面、yz面上的位置:
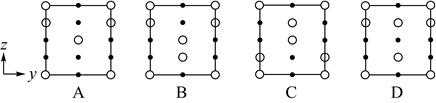
如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。(7)、分别用○、●表示H2PO 和K+ , KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO 、K+在晶胞xz面、yz面上的位置:
①若晶胞底边的边长均为apm、高为cpm,阿伏加德罗常数的值为NA , 晶体的密度__g•cm-3(写出表达式)。
②晶胞在x轴方向的投影图为__(填标号)。
 4. [化学——选修3:物质结构与性质]
4. [化学——选修3:物质结构与性质]过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用,回答下列问题:
(1)、对于基态Cr原子,下列叙述正确的是(填标号)。A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar] 3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)、三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是 , 中心离子的配位数为。(3)、[Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如下图所示。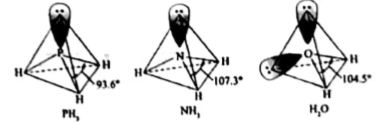
PH3中P的杂化类型是 , NH3的沸点比PH3的 , 原因是。H2O的键角小于NH3的,分析原因。
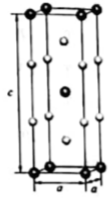
(4)、在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示。处于顶角位置的是原子。设Cr和Al原子半径分别为 和 ,则金属原子空间占有率为%(列出计算表达式)。5.(1)、用质谱仪检测气态乙酸时,谱图中出现质荷比(相对分子质量)为120的峰,原因是。(2)、金属镓(Ga)位于元素周期表中第4周期IIIA族,其卤化物的熔点如下表:GaF3
GaCl3
GaBr3
熔点/℃
> 1000
77. 75
122. 3
GaF3熔点比GaCl3熔点高很多的原因是。
-