浙教版科学八年级下册化学计算专题
试卷更新日期:2021-06-15 类型:复习试卷
一、解答题
-
1. 做科学实验应提倡绿色环保。如图为某种“微型”实验装置,实验使用药品的量少,产生的废弃物也少。用该仪器完成“制取并检验CO2”的实验只消耗了0.66克10%的盐酸。化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑

 (1)、“微型塑料滴管”相当于乙图实验装置中的 。(填字母)(2)、请计算利用该“微型”实验装置进行实验的过程中产生CO2的质量是多少克?(结果保留两位小数)2. 为研究影响化学反应快慢的因素,某同学选取成分相同的粉末状大理石、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸在锥形瓶中反应(样品中杂质不与稀盐酸反应),实验装置如图所示。实验中每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳质量,数据记录见下表:
(1)、“微型塑料滴管”相当于乙图实验装置中的 。(填字母)(2)、请计算利用该“微型”实验装置进行实验的过程中产生CO2的质量是多少克?(结果保留两位小数)2. 为研究影响化学反应快慢的因素,某同学选取成分相同的粉末状大理石、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸在锥形瓶中反应(样品中杂质不与稀盐酸反应),实验装置如图所示。实验中每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳质量,数据记录见下表:
时间/分
0
2
4
6
8
10
12
14
16
18
粉末状大理石生成的CO2质量/克
0
1.45
1.75
1.96
2.10
2.16
2.19
2.20
2.20
2.20
块状大理石生成的CO2质量/克
0
0.45
0.80
1.10
1.36
1.60
1.81
1.98
2.11
2.18
(1)、实验过程中,判断反应结束的现象是;(2)、分析数据可知影响反应快慢的因素有 。(3)、该大理石样品中含碳酸钙的质量分数是多少?(写出计算过程)3. 为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如下表。
时间/分
0
2
4
6
8
10
12
14
16
18
大理石碎屑生成的
CO2质量/克
0
1.45
1.75
1.98
2.18
2.30
2.36
2.40
2.40
2.40
块状大理石生成的
CO2质量/克
0
0.45
0.80
1.10
1.36
1.60
1.81
1.98
2.11
2.20
(1)、实验过程中,通过观察如图装置中的哪一现象可判断反应结束?(2)、结合表格分析,块状大理石与稀盐酸反应最多能生成多少克二氧化碳?简要说明判断的理由:(3)、当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应(写出计算过程)4. 复合墙纸是室内装饰的常用材料,含大量碳酸钙,有低碳环保的优势。为测定复合墙纸中碳酸钙的含量,某同学称取50克复合墙纸样品,平均分成5份,分别加入溶质质量分数相同、质量不同的稀盐酸中进行实验(化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑),实验数据如表:(假设墙纸中的其它成分既不溶于水,也不与稀盐酸反应)组别 1 2 3 4 5 加入样品的质量/克 10 10 10 10 10 加入稀盐酸的质量/克 10 20 30 40 50 充分反应后生成气体的质量/克 0.44 0.88 1.32 1.54 1.54 (1)、根据实验数据判断盐酸过量的组别是。(2)、根据化学方程式列式计算该样品中碳酸钙的质量分数。(3)、该稀盐酸中氯元素的质量分数为。5. 石灰石是主要矿产品之一。某校研究性学习小组想要测量当地矿石中含CaCO3的质量分数。取一些矿石样品,再取稀盐酸200克并平均分成4份,进行实验。实验结果如下:实验组别
1
2
3
4
加样品的质量(克)
5
10
15
20
生成CO2的质量(克)
1.76
M
4.4
4.4
 (1)、哪几次反应中矿石有剩余? 。(2)、上表中M的数值是。(3)、如果采用如上右图所示的装置制取并收集气体,再利用二氧化碳密度求出二氧化碳气体质量。则下列说法正确的是。
(1)、哪几次反应中矿石有剩余? 。(2)、上表中M的数值是。(3)、如果采用如上右图所示的装置制取并收集气体,再利用二氧化碳密度求出二氧化碳气体质量。则下列说法正确的是。A、若反应时间过短,会因反应不充分,使测量结果不准。
B、若反应一段时间后,排出反应装置内原有空气再连接收集气体装置,会使结果更准确
(4)、试计算这种矿石中CaCO3的质量分数。6. 某课外小组,用大理石与盐酸反应制取二氧化碳(大理石中杂质不与盐酸反应).甲、乙、丙三同学分别进行实验,实验数据如下(烧杯的质量为20.0g)。烧杯+盐酸
大理石
充分反应后烧杯+剩余物
甲
75.0g
25.0g
95.6g
乙
75.0g
30.0g
100.6g
丙
95.0g
25.0g
115.6g
若甲、乙、丙三同学中有一名同学所取的大理石和盐酸恰好完全反应,请回答下列问题.
(1)、同学所取的盐酸与大理石恰好完全反应.(2)、计算大理石中碳酸钙的质量分数.7. 某学习小组在实验室中用加热KClO3和MnO2混合物的方法制取O2 , 反应过程中固体质量变化如图所示,请计算。 (1)、制取O2的质量是g。(2)、原混合物中KClO3的质量分数。(写出计算过程,计算结果精确到0.1%)8. 在中考实验操作考试中,某同学抽到了做“氧气的制取和性质”实验,给他的实验器材有:样品(主要成分为氯酸钾)、二氧化锰、大试管、铁架台、铁夹、酒精灯、火柴、导管、集气瓶、集气瓶盖、水槽、抹布等。(2KClO3 2KCl+3O2↑)
(1)、制取O2的质量是g。(2)、原混合物中KClO3的质量分数。(写出计算过程,计算结果精确到0.1%)8. 在中考实验操作考试中,某同学抽到了做“氧气的制取和性质”实验,给他的实验器材有:样品(主要成分为氯酸钾)、二氧化锰、大试管、铁架台、铁夹、酒精灯、火柴、导管、集气瓶、集气瓶盖、水槽、抹布等。(2KClO3 2KCl+3O2↑) (1)、清点器材时,他发现要完成实验还缺少的器材是。(2)、如图是他的实验装置,请说出装置的两处明显错误。。(3)、改正实验装置后,进行实验,用5克样品完全反应共制得1.6g氧气,请计算样品中钾元素的质量(样品中的杂质不含钾元素)?(保留1位小数)9. 如图甲所示,在锥形瓶中放入石灰石12.5克(主要成分为碳酸钙,杂质既不与盐酸反 应,也不溶解于水),加入足量稀盐酸充分反应,锥形瓶总质量随时间变化如图乙所 示。请计算:
(1)、清点器材时,他发现要完成实验还缺少的器材是。(2)、如图是他的实验装置,请说出装置的两处明显错误。。(3)、改正实验装置后,进行实验,用5克样品完全反应共制得1.6g氧气,请计算样品中钾元素的质量(样品中的杂质不含钾元素)?(保留1位小数)9. 如图甲所示,在锥形瓶中放入石灰石12.5克(主要成分为碳酸钙,杂质既不与盐酸反 应,也不溶解于水),加入足量稀盐酸充分反应,锥形瓶总质量随时间变化如图乙所 示。请计算: (1)、生成二氧化碳的质量为克;(2)、石灰石样品中碳酸钙的质量分数是多少?10. 对实验装置进行微型化改进是保证实验绿色环保的一个重要途径。如图甲是实验室制取并检验CO2的装置,如图乙是对图甲实验装置进行微型化改进后的装置。
(1)、生成二氧化碳的质量为克;(2)、石灰石样品中碳酸钙的质量分数是多少?10. 对实验装置进行微型化改进是保证实验绿色环保的一个重要途径。如图甲是实验室制取并检验CO2的装置,如图乙是对图甲实验装置进行微型化改进后的装置。 (1)、图乙中微型塑料滴管在实验中的作用与图甲中的(填字母编号)仪器相同。(2)、通常用甲装置完成该实验需要的盐酸是“微型”实验装置用量的10倍,采用微型实验装置具有的优点是。(3)、用乙装置完成“某石灰石中CaCO3含量测定并检验CO2”的实验,已知所取石灰石样品的质量为0.125g,石灰石中所含的杂质不与盐酸反应。当滴加稀盐酸至反应恰好完成时,消耗0.73g10%的稀盐酸。请计算实验过程中产生CO2的质量和石灰石中CaCO3的质量分数是多少?11. 将9.5克KClO3和MnO2的混合物装入大试管中,加热至质量不再发生变化,冷却试管后称量,剩有6.62克固体物质。计算:(1)、写出上述涉及到的化学方程式。(2)、6.62克固体中含有哪些物质?各多少克?12. 用盐酸洗钢材会产生“酸洗废液”(主要成分为FeCl2).工业上用“酸洗废液”经高温氧化制取高纯氧化铁,同时产生的氯化氢气体可回收使用,主要反应原理为:4FeCl2+O2+4H2O 2Fe2O3+8HCl↑。某化工厂有5吨“酸洗废液”,经测定其中FeCl2的质量分数为25.4%.计算:(1)、这些“酸洗废液”中含FeCl2的质量为吨.(2)、这些“酸洗废液”在高温氧化的反应中,最多可以得到多少吨氯化氢气体?(写出计算过程及结果)13. 为确定影响化学反应速度快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品(样品中杂质不与稀盐酸反应)各6克,分别与足量的、溶质质量分数相同的稀盐酸反应,实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量。记录的前18分钟的数据如下表:
(1)、图乙中微型塑料滴管在实验中的作用与图甲中的(填字母编号)仪器相同。(2)、通常用甲装置完成该实验需要的盐酸是“微型”实验装置用量的10倍,采用微型实验装置具有的优点是。(3)、用乙装置完成“某石灰石中CaCO3含量测定并检验CO2”的实验,已知所取石灰石样品的质量为0.125g,石灰石中所含的杂质不与盐酸反应。当滴加稀盐酸至反应恰好完成时,消耗0.73g10%的稀盐酸。请计算实验过程中产生CO2的质量和石灰石中CaCO3的质量分数是多少?11. 将9.5克KClO3和MnO2的混合物装入大试管中,加热至质量不再发生变化,冷却试管后称量,剩有6.62克固体物质。计算:(1)、写出上述涉及到的化学方程式。(2)、6.62克固体中含有哪些物质?各多少克?12. 用盐酸洗钢材会产生“酸洗废液”(主要成分为FeCl2).工业上用“酸洗废液”经高温氧化制取高纯氧化铁,同时产生的氯化氢气体可回收使用,主要反应原理为:4FeCl2+O2+4H2O 2Fe2O3+8HCl↑。某化工厂有5吨“酸洗废液”,经测定其中FeCl2的质量分数为25.4%.计算:(1)、这些“酸洗废液”中含FeCl2的质量为吨.(2)、这些“酸洗废液”在高温氧化的反应中,最多可以得到多少吨氯化氢气体?(写出计算过程及结果)13. 为确定影响化学反应速度快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品(样品中杂质不与稀盐酸反应)各6克,分别与足量的、溶质质量分数相同的稀盐酸反应,实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量。记录的前18分钟的数据如下表: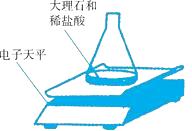
时间(分)
0
2
4
6
8
10
12
14
16
18
大理石碎屑生成的CO2的质量/克
0
1.45
1.75
1.98
2.18
2.30
2.36
2.40
2.40
2.40
块状大理石生成的CO2的质量/克
0
0.45
0.80
1.10
1.36
1.60
1.81
1.98
2.11
2.20
(1)、实验过程中,通过观察图中哪一现象可判断反应结束?。(2)、结合表格分析,6克块状大理石与稀盐酸反应最多能生成多少克二氧化碳?;简要说明判断的理由:。(3)、当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?14. 电解水实验中,为了增加水的导电性,可在水中加入一定量的稀硫酸。(1)、实验过程中,与电源正极相连的玻璃管内产生的气体是 。(2)、某次实验中,将10克10. 8%的稀硫酸倒入盛有98克水的烧杯中混合均匀得A溶液,则A溶液中溶质的质量分数为 。(3)、将A溶液全部倒入电解水装置,当通电反应到所剩溶液中的含水量为98%时,可制得 多少克氢气?15. 某碳酸钠样品含有少量的硫酸钠,取一定质量的该样品,完全溶解在水中配制成100g溶液,将其全部加入到100g一定质量分数的硫酸溶液中,恰好完全反应,生成的气体全部逸出后,所得溶液质量是195.6g,将溶液蒸干,得到15.6g硫酸钠.计算:
(1)加入的硫酸溶液的溶质质量分数;
(2)原碳酸钠样品中碳酸钠的质量分数(计算结果精确到0.1%).
16. 某学习小组用KClO3和MnO2的混合物加热制取O2 , 收集到4.8gO2后停止加热,称得剩余固体的质量为28.0g,继续加热至不再产生O2 , 最终剩余固体质量为23.2g,试计算(不考虑O2的损耗);(1)、两次生成O2的总质量为 g.(2)、理论上可回收到MnO2的质量(写出计算过程)17. 实验室有不纯的氯酸钾样品12.5g,把该样品与少量二氧化锰混合加热制取氧气(杂质不参加反应),充分反应后,固体混合物质量变化如下所示:反应前固体总质量
反应后固体总质量
13.5g
8.7g
(1)、生成氧气的质量为 g.(2)、氯酸钾在样品中的质量分数是多少?18. 取氯酸钾和二氧化锰的混合物13g,加热至混合物固体质量不再减少为止,冷却后称得剩余固体质量为8.2g,将剩余固体加入一定量的水中,充分搅拌后过滤,滤液是10%的氯化钾溶液(假设溶液无损失),计算:①生成氧气的质量;
②参加反应的氯酸钾的质量;(写出计算过程)。
19. CuSO4溶液对过氧化氢的分解有催化作用.取溶质质量分数为8.5%的过氧化氢溶液20g倒入小烧杯中,向其中加入溶质质量为0.75g 的CuSO4溶液10.8g,使过氧化氢完全分解.试计算:(1)产生氧气的质量;
(2)反应后所得溶液中CuSO4的质量分数.
20. 为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各 6 克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每 2 分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前 18 分钟数据如下。
时间/分
0
2
4
6
8
10
12
14
16
18
大理石碎屑生成的 CO2 质量/克
0
1.45
1.75
1.98
2.18
2.30
2.36
2.40
2.40
2.40
块状大理石生成的 CO2 质量/克
0
0.45
0.80
1.10
1.36
1.60
1.81
1.98
2.11
2.20
(1)、实验过程中,通过观察如图装置中的哪一现象可判断反应结束?。(2)、结合表格分析,块状大理石与稀盐酸反应最多能生成克二氧化碳?(3)、当反应进行到18 分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)21. 碳和氧化铜反应生成铜和二氧化碳.现有碳和氧化铜的混合物20g.其中氧元素的质量分数为18%,高温加热该混合物一段时间后,产生4.4g二氧化碳.计算:(1)参加反应的氧化铜的质量.
(2)剩余固体中氧元素的质量分数(计算结果保留到0.1%).
22.学习了金属的有关知识后,同学们知道了如何鉴别黄金和黄铜(铜锌合金,俗名“愚人金”),为进一步宣分析黄铜的成分,某同学进行了如下实验,称量黄铜样品20g放入锥形瓶中,向其中不断加入稀硫酸,收集生成的气体与所加稀硫酸的质量关系如图所示,求:
(1)黄铜样品中锌的质量.
(2)恰好完全反应时,所得溶液中溶质的质量分数.
 23. 取氯酸钾和二氧化锰的混合物13g,加热至混合物固体质量不再减少为止,冷却后称得固体质量为8.2g,将剩余固体加入一定量的水中,充分搅拌后过滤,滤液是10%的氯化钾溶液(假设溶液无损失),计算:(1)、生成氧气的质量是克;(2)、参加反应的氯酸钾的质量是多少克?(3)、氯化钾溶液的质量是多少克?24. 为测定大理石中碳酸钙的质量分数,某实验小组将 15g 大理石放在烧杯中,加入过量的稀盐酸,装置总质量随加入盐酸的变化关系如图。已知大理石中杂质不溶于水也不和盐酸反应。
23. 取氯酸钾和二氧化锰的混合物13g,加热至混合物固体质量不再减少为止,冷却后称得固体质量为8.2g,将剩余固体加入一定量的水中,充分搅拌后过滤,滤液是10%的氯化钾溶液(假设溶液无损失),计算:(1)、生成氧气的质量是克;(2)、参加反应的氯酸钾的质量是多少克?(3)、氯化钾溶液的质量是多少克?24. 为测定大理石中碳酸钙的质量分数,某实验小组将 15g 大理石放在烧杯中,加入过量的稀盐酸,装置总质量随加入盐酸的变化关系如图。已知大理石中杂质不溶于水也不和盐酸反应。 (1)、大理石中碳酸钙的质量分数为。(2)、m 的数值为。(3)、B 点的溶质为。(4)、计算 A 点溶质的质量分数。25.
(1)、大理石中碳酸钙的质量分数为。(2)、m 的数值为。(3)、B 点的溶质为。(4)、计算 A 点溶质的质量分数。25.某补钙药剂的标签主要内容如图所示,现测定该钙片含量是否符合标注,做如下实验:取10片该钙片,放入干燥、洁净的烧杯中,再向烧杯中加入50g某浓度稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的质量为64.5g.求:
 (1)、反应中生成二氧化碳的质量;(2)、通过计算说明每片钙片实际钙含量.说明是否与标注相符?(3)、试计算所用稀盐酸的溶质质量分数.26. 某科学兴趣小组的同学为了测定实验室中氯酸钾样品的纯度,取一定质量的该样品与1克二氧化锰混合,其总质量为6克。依次加热该混合物t1、t2、t3、t4时间后,分别冷却称量剩余固体质量,记录的有关数据如表所示(样品中的杂质不参与化学反应),请回答:
(1)、反应中生成二氧化碳的质量;(2)、通过计算说明每片钙片实际钙含量.说明是否与标注相符?(3)、试计算所用稀盐酸的溶质质量分数.26. 某科学兴趣小组的同学为了测定实验室中氯酸钾样品的纯度,取一定质量的该样品与1克二氧化锰混合,其总质量为6克。依次加热该混合物t1、t2、t3、t4时间后,分别冷却称量剩余固体质量,记录的有关数据如表所示(样品中的杂质不参与化学反应),请回答:加热时间
t1
t2
t3
t4
剩余固体质量/克
4.24
4.16
4.08
4.08
(1)、完全反应后产生的氧气的总质量为。(2)、样品中氯酸钾的纯度是多少?27.测定石灰石中的碳酸钙的含量,取出2.5克石灰石样品,逐渐加入稀盐酸,充分反应后测得剩余固体质量与加入稀盐酸的质量关系如图所示.(已知CaCO3+2HCl═CaCl2+H2O+CO2↑杂质不参与反应,也不溶于水)
 (1)、石灰石样品中碳酸钙的质量是 g;(2)、石灰石样品中碳酸钙的质量分数是 ;(3)、计算稀盐酸溶质的质量分数.28.
(1)、石灰石样品中碳酸钙的质量是 g;(2)、石灰石样品中碳酸钙的质量分数是 ;(3)、计算稀盐酸溶质的质量分数.28.向盛有100g稀硫酸的烧杯中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入NaOH溶液,所得沉淀质量与加入NaOH溶液的质量关系如图所示
 (1)、计算氢氧化钠溶液的溶质质量分数;(要求写出计算过程)(2)、与氢氧化钠溶液反应所消耗硫酸溶质的质量为 克.29.
(1)、计算氢氧化钠溶液的溶质质量分数;(要求写出计算过程)(2)、与氢氧化钠溶液反应所消耗硫酸溶质的质量为 克.29.某氢氧化钙粉末中含有碳酸钙杂质.现取样品15g于锥形瓶中并加适量水搅拌得悬浊液,然后向锥形瓶中滴加稀盐酸,充分反应,测得加入稀盐酸的质量与反应生成气体的质量关系如图所示.
 (1)、生成二氧化碳的质量是 g;(2)、加入60g稀盐酸后所得溶液中含有的溶质是 、 (填化学式);(3)、计算样品中碳酸钙的质量分数(写出计算过程,结果精确到0.1%).30.
(1)、生成二氧化碳的质量是 g;(2)、加入60g稀盐酸后所得溶液中含有的溶质是 、 (填化学式);(3)、计算样品中碳酸钙的质量分数(写出计算过程,结果精确到0.1%).30.菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图所示
已知:①FeCO3+H2SO4=FeSO4+CO2↑+H2O ②菱铁矿中杂质不参加反应,且难溶于水.
请计算:
 (1)、20.0g菱铁矿中FeCO3的质量为 g.(2)、列式计算所用稀硫酸的溶质质量分数(结果准确到0.1%)
(1)、20.0g菱铁矿中FeCO3的质量为 g.(2)、列式计算所用稀硫酸的溶质质量分数(结果准确到0.1%)