浙教版科学八年级下册期末复习综合卷(二)
试卷更新日期:2021-06-15 类型:复习试卷
一、单选题
-
1. 胭脂红是一种安全的食品添加剂,其化学式是C20H11N2O10S3Na3 . 下列关于胭脂红的说法正确的是( )A、该物质是由五种元素组成的 B、1个胭脂红分子中含有49个原子 C、该化合物中硫元素的质量分数最大 D、该化合物的相对分子质量为604g2. 小强是班里出了名的“粗心大王”,以下是从他的课堂笔记中摘录下来的部分物质的化学式,其中错误的是()A、铝 Al B、氯化钾 KCL C、氧化铜CuO D、五氧化二磷P2O53.
图中表示一段时间内某植物叶片吸收二氧化碳与光照强度关系示意图.以下分析正确的是( )
 A、ab段表示该植物不进行光合作用 B、bc段表示该植物的光合作用不断增强 C、b点表示该植物既不进行光合作用,也不进行呼吸作用 D、cd段表示该植物的光合作用不再进行4. 下列叙述中,正确的是( )A、若两种微粒的核外电子数相同,这两种微粒一定属于同种元素 B、若两种分子的质子数相同,这两种分子一定含有相同的电子数 C、若两种微粒属于同种元素,这两种微粒的中子数一定相同 D、若两种微粒属于同种元素,这两种微粒的最外层电子数一定相同5. 关于科学符号中数字“2”的含义,下列解释错误的是( )A、N2:表示氮气分子的个数为2 B、2Al:表示铝原子的个数为2 C、S2-:表示一个硫离子带2个单位负电荷 D、表示氧化镁中镁元素的化合价为+2价6. 连接如图电路,提供足够数量的大头针,只通过控制开关和调节滑动变阻器滑片的位置,无法探究 ( )
A、ab段表示该植物不进行光合作用 B、bc段表示该植物的光合作用不断增强 C、b点表示该植物既不进行光合作用,也不进行呼吸作用 D、cd段表示该植物的光合作用不再进行4. 下列叙述中,正确的是( )A、若两种微粒的核外电子数相同,这两种微粒一定属于同种元素 B、若两种分子的质子数相同,这两种分子一定含有相同的电子数 C、若两种微粒属于同种元素,这两种微粒的中子数一定相同 D、若两种微粒属于同种元素,这两种微粒的最外层电子数一定相同5. 关于科学符号中数字“2”的含义,下列解释错误的是( )A、N2:表示氮气分子的个数为2 B、2Al:表示铝原子的个数为2 C、S2-:表示一个硫离子带2个单位负电荷 D、表示氧化镁中镁元素的化合价为+2价6. 连接如图电路,提供足够数量的大头针,只通过控制开关和调节滑动变阻器滑片的位置,无法探究 ( )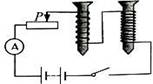 A、电流的有无对电磁铁磁性有无的影响 B、电流方向对电磁铁磁场方向的影响 C、电流大小对电磁铁磁场强弱的影响 D、线圈匝数对电磁铁磁场强弱的影响7.
A、电流的有无对电磁铁磁性有无的影响 B、电流方向对电磁铁磁场方向的影响 C、电流大小对电磁铁磁场强弱的影响 D、线圈匝数对电磁铁磁场强弱的影响7.如图表示人体胸廓容积的变化,到b点时,肺泡内,呼吸道,外界气压的关系是( )
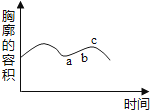 A、肺泡内=呼吸道>外界 B、肺泡内=呼吸道<外界 C、肺泡内<呼吸道<外界 D、肺泡内>呼吸道>外界8. 某阳离子Mn+的核外电子共有x个电子,核内有y个中子,则M的相对原子质量约为( )A、x+y B、x+y+n C、x﹣n+y D、x+n﹣y9. 施肥不当常造成植株“烧苗”,是因为( )A、土壤溶液浓度高,根毛细胞液的浓度低 B、土壤溶液浓度高,根毛细胞质的浓度低 C、土壤溶液浓度低,根毛细胞液的浓度高 D、土壤溶液浓度低,根毛细胞质的浓度高10. 有①氮气,②碘,③金刚石,④水,⑤水银,⑥高锰酸钾,⑦氧气,⑧磷8种物质。其中由原子直接构成的是( )A、②③⑧ B、③⑤⑧ C、②⑤⑦ D、①④⑥11. 在一密闭容器内有氧气、二氧化碳、水蒸气和一种未知物W,在一定条件下充分反应,测得反应前后各物质的质量如表所示,则下列说法中错误的是( )。
A、肺泡内=呼吸道>外界 B、肺泡内=呼吸道<外界 C、肺泡内<呼吸道<外界 D、肺泡内>呼吸道>外界8. 某阳离子Mn+的核外电子共有x个电子,核内有y个中子,则M的相对原子质量约为( )A、x+y B、x+y+n C、x﹣n+y D、x+n﹣y9. 施肥不当常造成植株“烧苗”,是因为( )A、土壤溶液浓度高,根毛细胞液的浓度低 B、土壤溶液浓度高,根毛细胞质的浓度低 C、土壤溶液浓度低,根毛细胞液的浓度高 D、土壤溶液浓度低,根毛细胞质的浓度高10. 有①氮气,②碘,③金刚石,④水,⑤水银,⑥高锰酸钾,⑦氧气,⑧磷8种物质。其中由原子直接构成的是( )A、②③⑧ B、③⑤⑧ C、②⑤⑦ D、①④⑥11. 在一密闭容器内有氧气、二氧化碳、水蒸气和一种未知物W,在一定条件下充分反应,测得反应前后各物质的质量如表所示,则下列说法中错误的是( )。 A、根据质量守恒定律,X的值应为0 B、反应后的生成物是二氧化碳和水 C、氧元素的化合价在反应前后发生改变 D、物质W只含碳、氢两种元素12. 有3种不同的原子,甲原子核内有6个质子和6个中子,乙原子核内有6个质子和8个中子,丙原子核内有7个质子和7个中子.下列说法正确的是( )A、甲和乙是同一种元素 B、甲和乙的核电荷数不同 C、乙和丙核外电子数相等 D、乙和丙互为同位素原子13. 某学生在加热氯酸钾制氧气的实验中,错把高锰酸钾当成二氧化锰放入氯酸钾中,其结果是( )A、反应速率不变,生成氧气的量不变 B、反应速率快,生成氧气的量减少 C、反应速率不变,生成氧气的量增多 D、反应速率快,生成氧气的量增多14. 某农场需要购置NH4NO3和CO(NH2)2两种化肥,总质量为100kg,经测得其中含氢元素的质量分数为6%,则两种化肥中含氮元素的总质量为( )A、36kg B、40kg C、42kg D、50kg15. 如图所示的三个铁块,正确的判断是( )
A、根据质量守恒定律,X的值应为0 B、反应后的生成物是二氧化碳和水 C、氧元素的化合价在反应前后发生改变 D、物质W只含碳、氢两种元素12. 有3种不同的原子,甲原子核内有6个质子和6个中子,乙原子核内有6个质子和8个中子,丙原子核内有7个质子和7个中子.下列说法正确的是( )A、甲和乙是同一种元素 B、甲和乙的核电荷数不同 C、乙和丙核外电子数相等 D、乙和丙互为同位素原子13. 某学生在加热氯酸钾制氧气的实验中,错把高锰酸钾当成二氧化锰放入氯酸钾中,其结果是( )A、反应速率不变,生成氧气的量不变 B、反应速率快,生成氧气的量减少 C、反应速率不变,生成氧气的量增多 D、反应速率快,生成氧气的量增多14. 某农场需要购置NH4NO3和CO(NH2)2两种化肥,总质量为100kg,经测得其中含氢元素的质量分数为6%,则两种化肥中含氮元素的总质量为( )A、36kg B、40kg C、42kg D、50kg15. 如图所示的三个铁块,正确的判断是( ) A、都是磁体 B、都不是磁体 C、只有两个是磁体 D、可能都是磁体,也可能只有两个是磁体16.
A、都是磁体 B、都不是磁体 C、只有两个是磁体 D、可能都是磁体,也可能只有两个是磁体16.如图为肺泡内的气体交换示意图.下列相关叙述不正确的是( )
 A、过程a、b是通过人体的呼吸运动实现的 B、过程c、d是通过气体扩散实现的 C、与血管甲相比,血管丙内的血液含有更丰富的氧气 D、血管乙处是人体内二氧化碳浓度最大的地方17. 已知R元素的相对原子质量m与其原子核内的质子数和中子数之和在数值上相等。若R2+核外有x个电子,则其原子核内的中子数为( )A、m-x+2 B、m+x-2 C、m-x-2 D、m+x+218. 下列实验现象描述正确的是( )A、红磷在空气中燃烧产生大量白烟 B、硫在氧气中燃烧产生苍白色火焰 C、铁丝在空气中剧烈燃烧,火星四射 D、镁在空气中燃烧,发出耀眼的白光,生成氧化镁19. 植物的根尖能够不断向前伸长,最主要的部位是( )A、分生区 B、伸长区 C、根冠 D、成熟区20. 实验室常用加热高锰酸钾的方法制取氧气。现对一定量的高锰酸钾固体进行加热,加热过程中涉及到的相关量随反应时间变化的图像正确的是( )A、
A、过程a、b是通过人体的呼吸运动实现的 B、过程c、d是通过气体扩散实现的 C、与血管甲相比,血管丙内的血液含有更丰富的氧气 D、血管乙处是人体内二氧化碳浓度最大的地方17. 已知R元素的相对原子质量m与其原子核内的质子数和中子数之和在数值上相等。若R2+核外有x个电子,则其原子核内的中子数为( )A、m-x+2 B、m+x-2 C、m-x-2 D、m+x+218. 下列实验现象描述正确的是( )A、红磷在空气中燃烧产生大量白烟 B、硫在氧气中燃烧产生苍白色火焰 C、铁丝在空气中剧烈燃烧,火星四射 D、镁在空气中燃烧,发出耀眼的白光,生成氧化镁19. 植物的根尖能够不断向前伸长,最主要的部位是( )A、分生区 B、伸长区 C、根冠 D、成熟区20. 实验室常用加热高锰酸钾的方法制取氧气。现对一定量的高锰酸钾固体进行加热,加热过程中涉及到的相关量随反应时间变化的图像正确的是( )A、 B、
B、 C、
C、 D、
D、
二、填空题
-
21.(1)、某三价金属与氧元素形成的化合物中氧元素质量分数为30%,则该金属的相对原子质量为。(2)、A、B两元素相对原子质量之比为2∶1,仅由这两种元素组成的化合物里,A、B两元素质量比为2∶3,则该化合物的化学式为;若其中B为-n价,则此化合物中A元素的化合价为。(3)、元素R可与氧形成多种化合物,其中RO中含氧53.33%,那么相对分子质量为76,含氧量为63.16%的R与氧元素形成的化合物的化学式是。22.
请回答下列问题
(1)如图为某化学反应的微观示意图,图中“●”表示氧原子,“○”表示氢原子.

①该反应的基本反应类型为 .
②结合图示分析,该反应前后发生改变的粒子是 .
(2)地球上的总水储量虽然很大,但淡水很少,大部分是含盐很高的海水.而海水淡化的成本很高,目前尚不能推广,从成分的角度考虑,你理解的“海水淡化”是指;实验室有一杯海水,要将其变为纯净的水,你认为最可行的方法是 .
23.如图所示,根据磁感线方向,可以判断:电源的a端为 极,小磁针的b端为 极
 24.(1)、用化学符号表示:
24.(1)、用化学符号表示:①3个二氧化碳分子;②氧化铁;③4个硫酸根离子;
(2)、指出化学符号中“2”的含义:H2O;Mg2+25. 在FeO、Fe2O3、Fe3O4三种化合物中,与等质量的铁元素相结合的氧元素的质量比;使CO2和CO中含有相同质量的氧元素,则CO2和CO的质量比是;质量相等的CO2和CO中,氧元素的质量比是;26. 有A、B、C、D四种物质,A是无色无味的气体;B在A中燃烧发出明亮的蓝紫色火焰,同时生成一种无色无味的有刺激性气味的气体C;D是一种无色气体,把D通入澄清石灰水中,石灰水变浑浊。试判断A、B、C、D个是什么物质。请把答案填在空格内。A是;B是;C是;D是。你能用符号把它们表示出来吗?试试看:A是;B是;C是;D是。
三、实验探究题
-
27.
某课外活动小组在学习了书本 “空气中氧气含量的测定”实验,知道P2O5 不能随便排放在空气中,否则会对空气造成污染,所以对该实验进行了改进:
在由两个注射器组成的密闭系统内共有50 mL空气,如右图。然后给装有红磷的玻璃管加热。同时交替推动两个注射器的活塞,至玻璃管内的红磷变成白烟,且较长时间内无进一步变化时停止。停止加热后,待冷却至室温将气体全部推至一个注射器内。

请根据你对上述实验的理解,回答下列问题:
(1)、实验结束后,注射器内的气体体积理论上应该减少约mL。
(2)、在实验的加热过程中,交替缓慢推动两个注射器的目的是。(3)、通过上面的实验,你学到的测量混合物中某成分含量的方法是28. 实脸室用双氧水与二氧化锰粉未混合制氧气。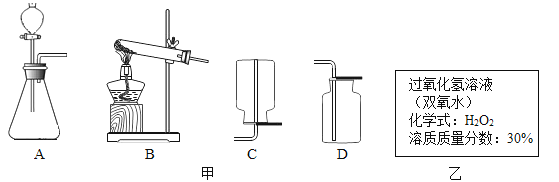 (1)、反应的发生装置和收集装置分别选择甲图中的 。(2)、实验室提供的过氧化氢溶液标签如乙图。查阅资料得知:溶质质量分数10%的双氧水更适合制取氧气。将100克溶质质量分数30%的双氧水,配制成溶质质量分数10%的双氧水需加水 毫升。(3)、取30 克稀释后的双氧水与适最的二氧化锰粉未混合,根据化学方程式计算,理论上可制得氧气多少克?(结果保留一位小数)29.
(1)、反应的发生装置和收集装置分别选择甲图中的 。(2)、实验室提供的过氧化氢溶液标签如乙图。查阅资料得知:溶质质量分数10%的双氧水更适合制取氧气。将100克溶质质量分数30%的双氧水,配制成溶质质量分数10%的双氧水需加水 毫升。(3)、取30 克稀释后的双氧水与适最的二氧化锰粉未混合,根据化学方程式计算,理论上可制得氧气多少克?(结果保留一位小数)29.七年级探究性学习小组的同学在学习了《生物圈中的绿色植物》相关知识后,利用课余时间,用银边天竺葵作实验材料,对“绿色植物进行光合作用”实验作了进一步探究.请根据以下图示,回答下列问题.
 (1)、请根据图示,写出正确的操作步骤:(2)、上述图②操作有误,请改正:(3)、步骤①中,A、B两装置形成了相互对照,其变量是 ;步骤⑥中,a与b相互对照所得出的结论是 。(4)、进行④和⑤的目的,是为了检验叶片中是否含有 。(5)、步骤⑦中,一昼夜后试管中澄清的石灰水变浑浊,主要原因是 。(6)、受该实验的启发,在农业生产中,为了提高温室内农作物的产量可采取哪些有效措? (请答出两条) 。30.
(1)、请根据图示,写出正确的操作步骤:(2)、上述图②操作有误,请改正:(3)、步骤①中,A、B两装置形成了相互对照,其变量是 ;步骤⑥中,a与b相互对照所得出的结论是 。(4)、进行④和⑤的目的,是为了检验叶片中是否含有 。(5)、步骤⑦中,一昼夜后试管中澄清的石灰水变浑浊,主要原因是 。(6)、受该实验的启发,在农业生产中,为了提高温室内农作物的产量可采取哪些有效措? (请答出两条) 。30.燃烧是我们熟悉的现象.某实验小组用如图实验方法来探究燃烧的条件:
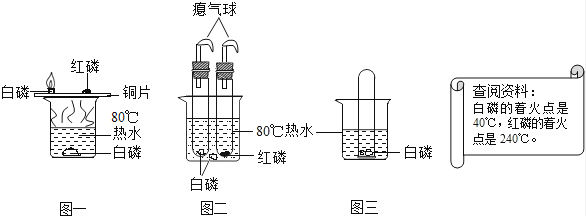 (1)、如图一进行实验,观察实验现象.红磷不能燃烧是因为 , 水中白磷不能燃烧是因为 .(2)、改进后的装置(如图二)与图一相比,其优点是 .欲使图二中的红磷着火,可将试管从水中取出并后才能对试管加热.(3)、将装有某气体的大试管口朝下垂直插入水中,使试管罩住白磷(如图三所示),结果观察到了“水火相容”的奇观,则大试管所装气体可能是 .(4)、“水火不相容”是指水能灭火,其实水有时也可以“生火”.比如用脱脂棉包裹好过氧化钠(Na2O2),往棉球上滴水即可看到“滴水生火”的奇观,因为过氧化钠遇到水生成O2和另一种物质,其反应的化学方程式为 ,该反应是(填“吸热”或“放热”)反应,但小明在一次表演中因为滴水过多却没有成功,他没有成功的原因是 .31. 为验证空气中氧气的体积分数,小明按图甲所示的装置进行了多次实验,发现每次测得的氧气体积分数 总是远小于 21%.他认为误差主要由实验装置造成,于是改用图乙装置进行实验,步骤如下:
(1)、如图一进行实验,观察实验现象.红磷不能燃烧是因为 , 水中白磷不能燃烧是因为 .(2)、改进后的装置(如图二)与图一相比,其优点是 .欲使图二中的红磷着火,可将试管从水中取出并后才能对试管加热.(3)、将装有某气体的大试管口朝下垂直插入水中,使试管罩住白磷(如图三所示),结果观察到了“水火相容”的奇观,则大试管所装气体可能是 .(4)、“水火不相容”是指水能灭火,其实水有时也可以“生火”.比如用脱脂棉包裹好过氧化钠(Na2O2),往棉球上滴水即可看到“滴水生火”的奇观,因为过氧化钠遇到水生成O2和另一种物质,其反应的化学方程式为 ,该反应是(填“吸热”或“放热”)反应,但小明在一次表演中因为滴水过多却没有成功,他没有成功的原因是 .31. 为验证空气中氧气的体积分数,小明按图甲所示的装置进行了多次实验,发现每次测得的氧气体积分数 总是远小于 21%.他认为误差主要由实验装置造成,于是改用图乙装置进行实验,步骤如下:
①连接装置并检査气密性.
②在量筒内加入100毫升的水.
③在广口瓶中加入少量水,使瓶内空气体积为250毫升.
④在燃烧匙内放入过量的红磷,塞紧瓶塞.关闭止水夹,接通电源使电烙铁发热,点燃红磷后,断开电源.
⑤燃烧结束并充分冷却后,打开止水夹,待量筒内水面不再下降时,记录量筒内水的体积为65毫升.
(1)、小明按图甲装置进行实验时,该如何检査装置的气密性?(2)、与装置甲相比,装置乙中使用电烙铁可以减小实误差,其原因是:(3)、根据本实验数据,计算出空气中氧气的体积分数为(4)、通过比较发现,小明的测量结果与真实值仍有差距,你认为引起本实验的误差还有什么?(写出一种因素即可.)32. 风是一种潜力很大的新能源,地球上可用来发电的风力资源,几乎是现在全世界水力发电量的10倍.目前全世界每年燃烧煤所获得的能量,只有风力在一年内所提供能量的三分之一.因此,国内外都很重视利用风力来发电,开发新能源.某学校科技小组结合所学知识,对“风力发电”展开探究.(1)、科技小组探究“风力发电”,应选取下列相应的哪套装置 , 原理是 .A.
 B.
B. 
C.
 D.
D.  (2)、下列实验中可以让磁场产生电流,必须的操作是_____(多选)A、实验时,开关要闭合,接通电路; B、电路的一部分导体,在磁场中运动; C、整个电路都在磁场中做切割磁感线运动; D、电路的一部分导体,在磁场中做切割磁感线运动; E、导体切割磁感线的速度必须要快;(3)、在探究感应电流方向与磁场方向的关系,应控制不变.(4)、在探究“感应电流大小与什么因素有关”时,科技小组的同学猜想:感应电流的大小可能与磁场的强弱和导体切割磁感线的速度有关。他们探究感应电流大小与磁场的强弱的关系,逐渐增大 , 但得到的感应电流变化不定,没有规律,原因是。(5)、风力发电的工作过程是将风能转化为叶片的动能,再通过发电机转化为能.
(2)、下列实验中可以让磁场产生电流,必须的操作是_____(多选)A、实验时,开关要闭合,接通电路; B、电路的一部分导体,在磁场中运动; C、整个电路都在磁场中做切割磁感线运动; D、电路的一部分导体,在磁场中做切割磁感线运动; E、导体切割磁感线的速度必须要快;(3)、在探究感应电流方向与磁场方向的关系,应控制不变.(4)、在探究“感应电流大小与什么因素有关”时,科技小组的同学猜想:感应电流的大小可能与磁场的强弱和导体切割磁感线的速度有关。他们探究感应电流大小与磁场的强弱的关系,逐渐增大 , 但得到的感应电流变化不定,没有规律,原因是。(5)、风力发电的工作过程是将风能转化为叶片的动能,再通过发电机转化为能.四、解答题
-
33. 某溶液中可能含有氢氧化钠、碳酸钠、硫酸钠、氯化钠、硝酸钠中的一种或几种,小明同学为了测定其成分,进行如下实验:取一定量的样品,如图在0-t 1 时刻加入氯化钡溶液,t 1 时刻之后逐渐加入稀硝酸直至过量,t 1 -t 2 滴加了40克稀硝酸,t 2 -t 3 滴加了100克稀硝酸,整个过程中产生沉淀的质量与时间的关系如图所示,请回答下列问题:
 (1)、BC段能观察到的实验现象是;(2)、由上述实验可知,原溶液中一定含有;(3)、整个反应过程中产生的气体质量为多少克?原溶液中一定含有的各溶质的质量为多少?34. 实验员在检查药品时,发现有一瓶装有烧碱的试剂瓶的瓶塞没塞紧,实验兴趣小组想测定该瓶中氢氧化钠的质量分数。小科取一定量的烧碱样品加水稀释,倒入放在电子秤上的烧杯内,然后将100g稀盐酸分5次加入烧杯中,记录实验数据如下表。
(1)、BC段能观察到的实验现象是;(2)、由上述实验可知,原溶液中一定含有;(3)、整个反应过程中产生的气体质量为多少克?原溶液中一定含有的各溶质的质量为多少?34. 实验员在检查药品时,发现有一瓶装有烧碱的试剂瓶的瓶塞没塞紧,实验兴趣小组想测定该瓶中氢氧化钠的质量分数。小科取一定量的烧碱样品加水稀释,倒入放在电子秤上的烧杯内,然后将100g稀盐酸分5次加入烧杯中,记录实验数据如下表。实验序号
1
2
3
4
5
加入稀盐酸质量/g
20
20
20
20
20
充分反应后电子秤的读数/g
220
240
258.9
276.7
295.6
(1)、在加入盐酸的过程中能观察到的现象是。(2)、实验取用的稀盐酸的质量分数是多少?(3)、该瓶中氢氧化钠的质量分数是多少?(不考虑氢氧化钠吸水潮解,结果保留到 0.1%)35. (NH4)2SO4、NH4NO3、CO(NH2)2是常见的化肥,对提高农作物产量有重要作用。(1)、NH4NO3中氮、氢、氧三种元素的质量比为。(2)、(NH4)2SO4中氮元素的质量分数为。(计算结果精确到0.1%)(3)、若某NH4NO3化肥样品中氮元素的质量分数为31.5%,计算该NH4NO3化肥样品中NH4NO3的质量分数(杂质不含氮元素)36. 赤铁矿(Fe2O3)的主要成分是氧化铁.某赤铁矿含氧化铁为80%,现有该赤铁矿石200t,试计算:(1)、这些赤铁矿石中含氧化铁的质量.(2)、这些赤铁矿石中含铁元素的质量.(3)、这些赤铁矿石中含铁元素的质量,相当于多少吨含四氧化三铁为90%的磁铁矿石中含铁元素的质量.(计算结果精确到0.1t)37. 某课外实践小组对某钢铁厂的钢样进行实验、分析、计算,了解产品的相关信息,假设钢铁中只含有Fe和C。将不同质量的钢样加入到相同溶质质量分数的稀硫酸中得到数据如下表:次数
加入钢样质量/g
加入稀硫酸质量/g
过滤得到反应后剩余溶液的质量/g
1
2.85
75
m
2
5.7
75
80.4
3
11.4
75
83.1
(1)、表格中m=。(2)、第2次所得剩余溶液中含有的溶质是。(写化学式) 。(3)、已知钢铁含碳量0.03%--2%,试分析计算说明钢样是否合格?(结果保留到0.01%)(4)、稀硫酸的溶质质量分数是多少?