2021年高考化学真题试卷(湖南卷)
试卷更新日期:2021-06-11 类型:高考真卷
一、单选题
-
1. 下列有关湘江流域的治理和生态修复的措施中,没有涉及到化学变化的是( )A、定期清淤,疏通河道 B、化工企业“三废”处理后,达标排放 C、利用微生物降解水域中的有毒有害物质 D、河道中的垃圾回收分类后,进行无害化处理2. 下列说法正确的是( )A、糖类、蛋白质均属于天然有机高分子化合物 B、 粉末在空气中受热,迅速被氧化成 C、 可漂白纸浆,不可用于杀菌、消毒 D、镀锌铁皮的镀层破损后,铁皮会加速腐蚀3. 下列实验设计不能达到实验目的的是( )
实验目的
实验设计
A
检验溶液中 是否被氧化
取少量待测液,滴加 溶液,观察溶液颜色变化
B
净化实验室制备的
气体依次通过盛有饱和 溶液、浓 的洗气瓶
C
测定 溶液的pH
将待测液滴在湿润的pH试纸上,与标准比色卡对照
D
工业酒精制备无水乙醇
工业酒精中加生石灰,蒸馏
A、A B、B C、C D、D4. 已二酸是一种重要的化工原料,科学家在现有工业路线基础上,提出了一条“绿色”合成路线: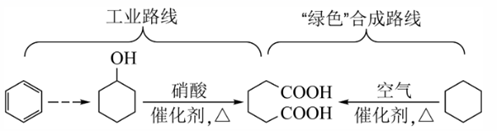
下列说法正确的是( )
A、苯与溴水混合,充分振荡后静置,下层溶液呈橙红色 B、环己醇与乙醇互为同系物 C、已二酸与 溶液反应有 生成 D、环己烷分子中所有碳原子共平面5. 为阿伏加德罗常数的值。下列说法正确的是( )A、 含有的中子数为 B、 溶液中含有的 数为 C、 与 在密闭容器中充分反应后的分子数为 D、 和 (均为标准状况)在光照下充分反应后的分子数为6. 一种工业制备无水氯化镁的工艺流程如下:
下列说法错误的是( )
A、物质X常选用生石灰 B、工业上常用电解熔融 制备金属镁 C、“氯化”过程中发生的反应为 D、“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水7. W、X、Y、Z为原子序数依次增大的短周期主族元素,Y的原子序数等于W与X的原子序数之和,Z的最外层电子数为K层的一半,W与X可形成原子个数比为2:1的 分子。下列说法正确的是( )A、简单离子半径: B、W与Y能形成含有非极性键的化合物 C、X和Y的最简单氢化物的沸点: D、由W、X、Y三种元素所组成化合物的水溶液均显酸性8. 常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为 。下列说法错误的是( )A、产生22.4L(标准状况) 时,反应中转移 B、反应中氧化剂和还原剂的物质的量之比为11:6 C、可用石灰乳吸收反应产生的 制备漂白粉 D、可用酸化的淀粉碘化钾溶液检验食盐中 的存在9. 常温下,用 的盐酸分别滴定20.00mL浓度均为 三种一元弱酸的钠盐 溶液,滴定曲线如图所示。下列判断错误的是( ) A、该 溶液中: B、三种一元弱酸的电离常数: C、当 时,三种溶液中: D、分别滴加20.00mL盐酸后,再将三种溶液混合:10. 锌溴液流电池是一种先进的水溶液电解质电池,广泛应用于再生能源储能和智能电网的备用电源等。三单体串联锌溴液流电池工作原理如图所:
A、该 溶液中: B、三种一元弱酸的电离常数: C、当 时,三种溶液中: D、分别滴加20.00mL盐酸后,再将三种溶液混合:10. 锌溴液流电池是一种先进的水溶液电解质电池,广泛应用于再生能源储能和智能电网的备用电源等。三单体串联锌溴液流电池工作原理如图所: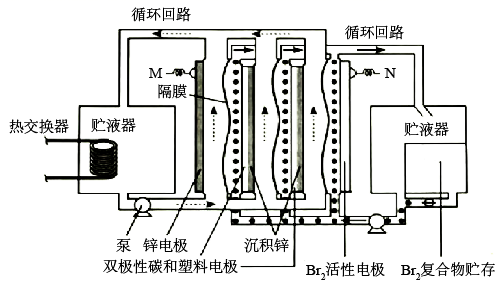
下列说法错误的是( )
A、放电时,N极为正极 B、放电时,左侧贮液器中 的浓度不断减小 C、充电时,M极的电极反应式为 D、隔膜允许阳离子通过,也允许阴离子通过二、选择题
-
11. 已知: ,向一恒温恒容的密闭容器中充入 和 发生反应, 时达到平衡状态I,在 时改变某一条件, 时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是( )
 A、容器内压强不变,表明反应达到平衡 B、 时改变的条件:向容器中加入C C、平衡时A的体积分数 : D、平衡常数K:12. 对下列粒子组在溶液中能否大量共存的判断和分析均正确的是( )
A、容器内压强不变,表明反应达到平衡 B、 时改变的条件:向容器中加入C C、平衡时A的体积分数 : D、平衡常数K:12. 对下列粒子组在溶液中能否大量共存的判断和分析均正确的是( )粒子组
判断和分析
A
、 、 、
不能大量共存,因发生反应:
B
、 、 、
不能大量共存,因发生反应:
C
、 、 、
能大量共存,粒子间不反应
D
、 、 、
能大量共存,粒子间不反应
A、A B、B C、C D、D13. 1-丁醇、溴化钠和70%的硫酸共热反应,经过回流、蒸馏、萃取分液制得1-溴丁烷粗产品,装置如图所示:
已知:
下列说法正确的是( )
A、装置I中回流的目的是为了减少物质的挥发,提高产率 B、装置Ⅱ中a为进水口,b为出水口 C、用装置Ⅲ萃取分液时,将分层的液体依次从下放出 D、经装置Ⅲ得到的粗产品干燥后,使用装置Ⅱ再次蒸馏,可得到更纯的产品14. 铁的配合物离子(用 表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法错误的是( )
A、该过程的总反应为 B、 浓度过大或者过小,均导致反应速率降低 C、该催化循环中 元素的化合价发生了变化 D、该过程的总反应速率由Ⅱ→Ⅲ步骤决定三、非选择题【必考题】
-
15. 碳酸钠俗称纯碱,是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,并测定产品中少量碳酸氢钠的含量,过程如下:
步骤I. 的制备
 步骤Ⅱ.产品中 含量测定
步骤Ⅱ.产品中 含量测定①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸 ;
③在上述锥形瓶中再加入2滴指示剂N,继续用 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸 ;
④平行测定三次, 平均值为22.45, 平均值为23.51。
已知:(i)当温度超过35℃时, 开始分解。
(ii)相关盐在不同温度下的溶解度表
温度/
0
10
20
30
40
50
60
35.7
35.8
36.0
36.3
36.6
37.0
37.3
11.9
15.8
21.0
27.0
6.9
8.2
9.6
11.1
12.7
14.5
16.4
29.4
33.3
37.2
41.4
45.8
50.4
55.2
回答下列问题:
(1)、步骤I中晶体A的化学式为 , 晶体A能够析出的原因是;(2)、步骤I中“300℃加热”所选用的仪器是_______(填标号);A、 B、
B、 C、
C、 D、
D、 (3)、指示剂N为 , 描述第二滴定终点前后颜色变化;(4)、产品中 的质量分数为(保留三位有效数字);(5)、第一滴定终点时,某同学俯视读数,其他操作均正确,则 质量分数的计算结果(填“偏大”“偏小”或“无影响”)。16. 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
(3)、指示剂N为 , 描述第二滴定终点前后颜色变化;(4)、产品中 的质量分数为(保留三位有效数字);(5)、第一滴定终点时,某同学俯视读数,其他操作均正确,则 质量分数的计算结果(填“偏大”“偏小”或“无影响”)。16. 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。方法I:氨热分解法制氢气
相关化学键的键能数据
化学键
键能
946
436.0
390.8
一定温度下,利用催化剂将 分解为 和 。回答下列问题:
(1)、反应 ;(2)、已知该反应的 ,在下列哪些温度下反应能自发进行?_______(填标号)A、25℃ B、125℃ C、225℃ D、325℃(3)、某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将 通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。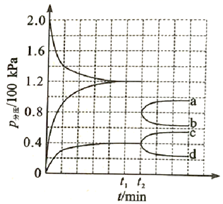
①若保持容器体积不变, 时反应达到平衡,用 的浓度变化表示 时间内的反应速率 (用含 的代数式表示)
② 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是(用图中a、b、c、d表示),理由是;
③在该温度下,反应的标准平衡常数 。(已知:分压=总压×该组分物质的量分数,对于反应 , ,其中 , 、 、 、 为各组分的平衡分压)。
方法Ⅱ:氨电解法制氢气
利用电解原理,将氮转化为高纯氢气,其装置如图所示。
 (4)、电解过程中 的移动方向为(填“从左往右”或“从右往左”);(5)、阳极的电极反应式为。
(4)、电解过程中 的移动方向为(填“从左往右”或“从右往左”);(5)、阳极的电极反应式为。KOH溶液KOH溶液
17. 可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以 形式存在,还含有 、 、 、 等物质。以独居石为原料制备 的工艺流程如下: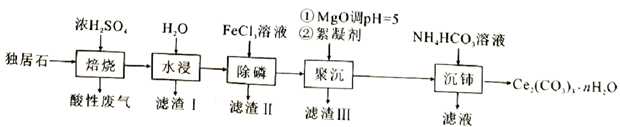
回答下列问题:
(1)、铈的某种核素含有58个质子和80个中子,该核素的符号为;(2)、为提高“水浸”效率,可采取的措施有(至少写两条);(3)、滤渣Ⅲ的主要成分是(填化学式);(4)、加入絮凝剂的目的是;(5)、“沉铈”过程中,生成 的离子方程式为 , 常温下加入的 溶液呈(填“酸性”“碱性”或“中性”)(已知: 的 , 的 , );(6)、滤渣Ⅱ的主要成分为 ,在高温条件下, 、葡萄糖( )和 可制备电极材料 ,同时生成 和 ,该反应的化学方程式为四、非选择题【选考题】
-
18. [选修3:物质结构与性质]
硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
(1)、基态硅原子最外层的电子排布图为 , 晶体硅和碳化硅熔点较高的是(填化学式);(2)、硅和卤素单质反应可以得到 , 的熔沸点如下表:熔点/K
183.0
203.2
278.6
393.7
沸点/K
187.2
330.8
427.2
560.7
①0℃时, 、 、 、 呈液态的是(填化学式),沸点依次升高的原因是 , 气态 分子的空间构型是;
② 与N-甲基咪唑
 反应可以得到 ,其结构如图所示:
反应可以得到 ,其结构如图所示:
N-甲基咪唑分子中碳原子的杂化轨道类型为 , H、C、N的电负性由大到小的顺序为 , 1个 中含有个 键;
(3)、下图是 、 、 三种元素形成的某化合物的晶胞示意图。
①已知化合物中 和 的原子个数比为1:4,图中Z表示原子(填元素符号),该化合物的化学式为;
②已知该晶胞的晶胞参数分别为anm、bnm、cnm, ,则该晶体的密度 (设阿伏加德罗常数的值为 ,用含a、b、c、 的代数式表示)。
19. [选修5:有机化学基础]叶酸拮抗剂 是一种多靶向性抗癌药物。以苯和丁二酸酐为原料合成该化合物的路线如下:
回答下列问题:

已知:①

②
 (1)、A的结构简式为;(2)、 , 的反应类型分别是 , ;(3)、M中虚线框内官能团的名称为a , b;(4)、B有多种同分异构体,同时满足下列条件的同分异构体有种(不考虑立体异构)
(1)、A的结构简式为;(2)、 , 的反应类型分别是 , ;(3)、M中虚线框内官能团的名称为a , b;(4)、B有多种同分异构体,同时满足下列条件的同分异构体有种(不考虑立体异构)①苯环上有2个取代基②能够发生银镜反应③与 溶液发生显色发应
其中核磁共振氢谱有五组峰,且峰面积之比为6:2:2:1:1的结构简式为;
(5)、结合上述信息,写出丁二酸酐和乙二醇合成聚丁二酸乙二醇酯的反应方程式;(6)、参照上述合成路线,以乙烯和 为原料,设计合成
为原料,设计合成  的路线(其他试剂任选)。
的路线(其他试剂任选)。