四川省成都市武侯区2021年中考化学二模试卷
试卷更新日期:2021-06-11 类型:中考模拟
一、单选题
-
1. 下列变化属于化学变化的是( )A、生石灰吸水干燥气体 B、氢氧化钠固体吸水潮解 C、分离液态空气制氧气 D、浓盐酸敞口放置出现白雾2. 下列实验操作正确的是( )A、熄灭酒精灯
 B、塞紧橡胶塞
B、塞紧橡胶塞  C、移走加热后的蒸发皿
C、移走加热后的蒸发皿  D、稀释浓硫酸
D、稀释浓硫酸 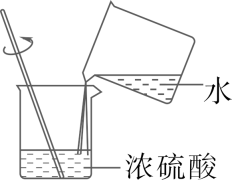 3. 分类是化学学习中常用的方法。下列有关物质分类正确的是( )A、单质:钢、液氧、红磷 B、碱:烧碱、纯碱、氨水 C、有机物:蛋白质、二氧化碳、乙醇 D、酸:盐酸、醋酸、硫酸4. 四川大学成功研制了我国首套二氧化碳零排放天然气制氢设备。该设备以液态金属锡为媒介,助力甲烷裂解,实现二氧化碳零排放、高效制氢。反应的微观示意图如下。下列说法正确的是( )
3. 分类是化学学习中常用的方法。下列有关物质分类正确的是( )A、单质:钢、液氧、红磷 B、碱:烧碱、纯碱、氨水 C、有机物:蛋白质、二氧化碳、乙醇 D、酸:盐酸、醋酸、硫酸4. 四川大学成功研制了我国首套二氧化碳零排放天然气制氢设备。该设备以液态金属锡为媒介,助力甲烷裂解,实现二氧化碳零排放、高效制氢。反应的微观示意图如下。下列说法正确的是( ) A、金属锡作反应的催化剂 B、反应中甲、丙分子个数比为1:1 C、反应中碳元素化合价降低 D、物质甲由1个碳原子和4个氢原子构成5. 建立“宏观一微观一符号”之间的联系是化学学科特有的思维方式。根据图中提供的信息判断,下列说法正确的是( )
A、金属锡作反应的催化剂 B、反应中甲、丙分子个数比为1:1 C、反应中碳元素化合价降低 D、物质甲由1个碳原子和4个氢原子构成5. 建立“宏观一微观一符号”之间的联系是化学学科特有的思维方式。根据图中提供的信息判断,下列说法正确的是( ) A、锶元素的相对原子质量为87.62g B、①和②两元素的化学性质相似 C、①和④元两素组成物质的化学式为SrCl2 D、③所示的元素位于第二周期6. 化学与生活、生产、环境密切相关。下列归纳完全正确的一组是( )
A、锶元素的相对原子质量为87.62g B、①和②两元素的化学性质相似 C、①和④元两素组成物质的化学式为SrCl2 D、③所示的元素位于第二周期6. 化学与生活、生产、环境密切相关。下列归纳完全正确的一组是( )A.化学与健康
B.化学与环境
①碘、铁、锌是人体必需的微量元素
②人体缺钙会引起贫血
③糖类、油脂、维生素是人体主要供能物质
①广泛使用新能源可以有效减少碳排放
②乱扔塑料可能引起白色污染
③煤燃烧产生的二氧化硫易形成酸雨
C.化学与安全
D.化学与材料
①点燃氢气前,一定要检验纯度
②煤气泄漏应立即打开排气扇抽气
③用煤炉取暖时,放置水能防止CO中毒
①塑料、棉花和合成橡胶属于合成材料
②生铁、四氧化三铁和黄金属于金属材料
③玻璃钢和钢筋混凝土属于复合材料
A、A B、B C、C D、D7. 钴(Co)的化合物在锂电池生产中应用广泛。LiCoO2(钴酸锂)在酸性条件下具有较强的氧化性,可发生如下反应: 。已知锂(Li)与钠原子最外层电子数相同。下列说法正确的是( )A、上述反应中共有7种含氧化合物 B、LiCoO2、Li2SO4、CoSO4都属于盐 C、LiCoO2中钴酸根离子的符号为CoO22- D、反应生成的水和氧气的质量比为4:18. 下列实验设计能达到实验目的的是( )选项
实验目的
实验设计
A
除去氯化钠溶液中三种可溶性杂质MgCl2、Na2SO4和CaCl2
依次加过量的氢氧化钡、碳酸钠溶液,过滤,再向滤液中加入适量的稀盐酸
B
证明硫酸与氢氧化钠反应后,硫酸过量
取样,加入硝酸钡溶液,观察现象
C
除去H2中混有的HCl气体
将气体通过盛有碳酸钠溶液的洗气瓶洗气
D
鉴别NaOH溶液和Na2CO3溶液
取样,分别加入酚酞试液,观察现象
A、A B、B C、C D、D9. 已知同温同压下,气体体积比等于气体的分子数目之比。常温下,向盛有一定量氧气的密闭容器通入氢气,用电火花点燃,使其充分反应,恢复至相同温度。测得容器中剩余气体的体积与通入氢气的体积关系如图所示。下列说法错误的是( ) A、B点表示氢气与氧气恰好反应 B、氧气的起始体积为2mL C、AB间,容器中剩余气体为氧气 D、C点对应纵坐标为(x-2)10. 向含有AgNO3和Cu(NO3)2的混合溶液中逐渐加入Zn粉,溶液的质量与加入Zn粉的质量关系如图所示。下列说法错误的是( )
A、B点表示氢气与氧气恰好反应 B、氧气的起始体积为2mL C、AB间,容器中剩余气体为氧气 D、C点对应纵坐标为(x-2)10. 向含有AgNO3和Cu(NO3)2的混合溶液中逐渐加入Zn粉,溶液的质量与加入Zn粉的质量关系如图所示。下列说法错误的是( ) A、ab间的反应为 B、c点溶液中的溶质仅有Zn(NO3)2一种 C、d点对应的固体只有2种单质 D、整个实验过程,溶液由蓝色变为无色11. 常温下,向滴有酚酞试液的氢氧化钠溶液中滴加稀盐酸,如图1所示,并不断搅拌。烧杯中溶液温度变化如图2所示。关于上述实验的有关说法中,正确的是( )
A、ab间的反应为 B、c点溶液中的溶质仅有Zn(NO3)2一种 C、d点对应的固体只有2种单质 D、整个实验过程,溶液由蓝色变为无色11. 常温下,向滴有酚酞试液的氢氧化钠溶液中滴加稀盐酸,如图1所示,并不断搅拌。烧杯中溶液温度变化如图2所示。关于上述实验的有关说法中,正确的是( )
①a点时,溶液中所含溶质为HCl、NaCl(酚酞除外)
②从b点到c点,溶液的pH逐渐变大
③c点时,溶液为无色
④实验说明该反应为放热反应
⑤比较溶液中离子数目多少:a=b<c
A、①②③ B、②③④ C、①③⑤ D、③④⑤12. 某固体粉末,可能含碳、镁、铜、氧化镁、氯化钠中的一种或几种。为探究该固体粉末的组成,设计如图所示实验。下列说法错误的是( ) A、实验表明所加硝酸银溶液一定是过量 B、白色固体C为AgCl,故原固体粉末中必含氯化钠 C、无法确定固体粉末中是否含氧化镁 D、蓝色溶液丙中一定含有Mg2+、H+、Cu2+13. 一定温度下,向盛有agNa2CO3溶液的烧杯中加入Ba(NO3)2固体,溶液的质量与加入Ba(NO3)2固体的质量变化关系如图所示。下列叙述错误的是( )
A、实验表明所加硝酸银溶液一定是过量 B、白色固体C为AgCl,故原固体粉末中必含氯化钠 C、无法确定固体粉末中是否含氧化镁 D、蓝色溶液丙中一定含有Mg2+、H+、Cu2+13. 一定温度下,向盛有agNa2CO3溶液的烧杯中加入Ba(NO3)2固体,溶液的质量与加入Ba(NO3)2固体的质量变化关系如图所示。下列叙述错误的是( ) A、Na2CO3完全反应时,消耗Ba(NO3)2的质量为ng B、反应生成BaCO3沉淀的质量为(a+n-b)g C、P点时对溶质 Ba(NO3)2而言,溶液达到饱和状态 D、m、n的关系为:m=c+n-a
A、Na2CO3完全反应时,消耗Ba(NO3)2的质量为ng B、反应生成BaCO3沉淀的质量为(a+n-b)g C、P点时对溶质 Ba(NO3)2而言,溶液达到饱和状态 D、m、n的关系为:m=c+n-a二、多选题
-
14. 20℃时,KCl的溶解度是34g。取40℃的KCl溶液65g放入烧杯中,如图甲。按图示进行操作(整个过程中忽略溶剂损失)。下列说法错误的是( )
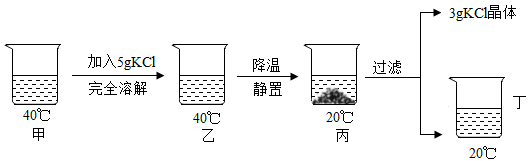 A、溶液中KCl的质量分数大小为:丙>甲 B、丁图溶液中溶质和溶剂的质量比为17:50 C、乙图中的KCl溶液一定为饱和溶液 D、实验可知,KCl的溶解度随温度升高而增大
A、溶液中KCl的质量分数大小为:丙>甲 B、丁图溶液中溶质和溶剂的质量比为17:50 C、乙图中的KCl溶液一定为饱和溶液 D、实验可知,KCl的溶解度随温度升高而增大三、填空题
-
15. 生活处处皆化学,厨房中蕴含着许多化学知识。回答下列问题:(1)、厨房中有食盐、食醋、小苏打、铁强化酱油等物质。焙制糕点所用发酵粉的主要成分是(写化学式);“铁强化酱油”中的“铁”指(填“单质”“原子”或“元素”);向食醋中加鸡蛋壳,可观察到的现象是;食盐的主要成分是氯化钠,氯化钠由(填符号)构成。(2)、用铁锅炒菜是利用金属的性;如果油锅着火,盖上锅盖即可灭火,其原理是。(3)、用洗洁精去除餐具油污时,洗洁精使油污分散成细小液滴,随水流动。这种现象称为。(4)、冰箱内放置活性炭可去除冰箱内的异味,是因为活性炭具有较强的性。(5)、长时间放置的铁质搁物架在地面上留下锈迹,可用稀盐酸将其除去,其反应的化学方程式为。
四、综合题
-
16. 某兴趣小组设计并完成如图所示的实验。

回答下列问题:
(1)、实验一中碟子底部出现黑色物质,该实验说明了。(2)、实验二中低处蜡烛先熄灭,高处蜡烛后熄灭,说明二氧化碳具有的物理性质是 , 具有的化学性质是。(3)、实验三的实验目的是。(4)、实验四的实验目的是比较铝和铜的金属活动性强弱。若选用图①和图②进行实验,可观察到的现象为。若选用图③进行实验,X与Y溶液能发生反应,其反应的化学方程式为。由实验四可得出结论:金属活动性强弱为:Al>Cu。
17. 小明从实验室向老师借了如下图所示的仪器完成实验。

回答下列问题:
(1)、仪器④的名称是。(2)、利用氯酸钾和二氧化锰来制取并收集O2 , 选择组装实验装置所需的仪器是(填序号)。为完成该实验,装置中还必需添加一种仪器,其名称为。该反应的化学方程式为。(3)、利用石灰石和盐酸制取、收集并检验CO2。①用如图所示充满空气的医用塑料袋收集二氧化碳,则二氧化碳应从(填“a”或“b”)端通入。

②将产生的CO2通入澄清石灰水溶液,未出现浑浊现象,可能的原因是。
18. A、B、C、D、E是初中化学常见的物质。其中D是一种常见的温室气体,E溶液能使紫色石蕊变红。A、B、C、D、E之间的关系如图所示。反应条件、部分反应物和生成物己略去,“一”表示相连的两种物质之间可以发生反应,“→”表示物质的转化关系。 (1)、写出下列物质的化学式:D。E。(2)、若A、B均为黑色固体,则A的化学式为。B与D的反应属于(填“放热”或“吸热”)反应。(3)、若A、B、C均为化合物,且A的阴离子与大理石主要成分的阴离子相同,则A的化学式为 , B与C反应的化学方程式为。19. 立德粉(ZnS·BaSO4)是一种常用白色颜料,以重晶石(BaSO4)为原料生产立德粉的主要工艺流程如下:
(1)、写出下列物质的化学式:D。E。(2)、若A、B均为黑色固体,则A的化学式为。B与D的反应属于(填“放热”或“吸热”)反应。(3)、若A、B、C均为化合物,且A的阴离子与大理石主要成分的阴离子相同,则A的化学式为 , B与C反应的化学方程式为。19. 立德粉(ZnS·BaSO4)是一种常用白色颜料,以重晶石(BaSO4)为原料生产立德粉的主要工艺流程如下:
资料:BaS可溶于水,ZnS和 BaSO4均难溶于水。
(1)、重金石与焦炭加入回转炉前先粉碎的目的是。回转炉中,重晶石(BaSO4)与焦炭在高温下焙烧制得BaS,其反应的化学方程式为 ,则X的化学式为。(2)、反应器中发生的化学反应属于基本反应类型中的反应。(3)、上述流程中,主要用于分离、提纯的设备有浸出槽、和洗涤槽。20.(1)、三星堆考古再次成为考古界的热点。此次考古出土了大量的青铜器、象牙等文物。青铜是铜、锡、铅组成的合金。青铜器中的铜在氯离子等作用下,生成活性很强的氯化亚铜(CuCl)。氯化亚铜易与氧气、水反应生成氯化氢和碱式氯化铜(化学式为Cu2(OH)3Cl),其反应的化学方程式为。去除文物表面的Cl-是保护青铜器文物的重要手段。(2)、同学们发现生活中铜制品长期露置在潮湿空气中也会锈蚀,生成“铜绿”(化学式为Cu2(OH)2CO3)。为探究生活中某铜样品的锈蚀程度(即该铜样品中单质铜的质量分数),并回收铜。查阅资料:①
②
实验设计:取铜样品(假设除铜和铜绿外,不含其它物质),设计甲、乙两方案。
方案甲:

操作Ⅰ、Ⅱ、Ⅲ的名称是 , 该操作中都要用到玻璃棒,其作用是。
(3)、若溶液B为浅绿色,任写一个步骤②中发生反应的化学方程式。(4)、溶液C中的金属离子。(填离子符号)(5)、步骤Ⅰ中铜绿受热分解生成黑色固体A、CO2和H2O,还发生另一个化合反应也生成黑色固体A,黑色固体A的化学式为。(6)、步骤Ⅱ所得铜中往往含有少量的Cu2O。检验铜中含有Cu2O的实验方法为(填实验步骤、实验现象)。(7)、数据处理:①根据方案甲中数据可知,铜样品中单质铜的质量分数为(小数点保留到0.1%)。
②利用方案乙还原16.0g黑色固体A,得到Cu和Cu2O的混合物共ag。则a的取值范围为<a<14.4g。
反思评价:
(8)、方案乙的主要缺点为(任写一条)。五、计算题
-
21. 双氧水是一种常见的消毒液,它是过氧化氢的水溶液。回答下列问题:(1)、过氧化氢中氧元素的化合价为。(2)、过氧化氢中氢元素和氧元素的质量比为。(3)、为了测定过氧化氢溶液中溶质的质量分数。
向烧杯中加入136g过氧化氢溶液,再向其中加入2g二氧化锰,至不再产生气泡为止,测得烧杯中剩余物质总质量为134.8g。
计算:①生成氧气的质量是g(不考虑氧气在水中的溶解)。
②过氧化氢溶液中溶质的质量分数是多少?
-
-