河南省焦作市2020-2021学年高一下学期化学期中考试试卷
试卷更新日期:2021-06-10 类型:期中考试
一、选择题:本题共16小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 五千年中华文化不仅能彰显民族自信、文化自信,还蕴含着许多化学知识。下列说法错误的是( )A、王维的“大漠孤烟直,长河落日圆”中的“烟”是胶体 B、白居易的“绿蚁新酒,红泥小火炉”中“红泥”一定含有Fe3O4 C、苏味道的“火树银花合,星桥铁锁开”中“火树银花”与金属的焰色反应有关 D、曹植的“煮豆燃豆萁,豆在釜中泣”中涉及的能量变化主要是化学能转化为热能2. 实验室加热固体使其分解时,下列仪器可能用到的是( )
序号
①
②
③
④
⑤
仪器




 A、①②⑤ B、①③④ C、①②③ D、①②③④3. 下列关于化学反应速率和化学反应限度的说法正确的是( )A、化学反应速率只能用单位时间内反应物浓度的减少来表示 B、反应速率数值大的反应进行得一定快 C、对于可逆反应而言,物质的浓度不变时,反应一定达到了该条件下的限度 D、一定条件下,可逆反应达到最大限度时,反应没有停止4. 下列说法错误的是( )A、物质CaHAsO4中含有两种长周期元素 B、SiO2超分子纳米管(微观结构如图
A、①②⑤ B、①③④ C、①②③ D、①②③④3. 下列关于化学反应速率和化学反应限度的说法正确的是( )A、化学反应速率只能用单位时间内反应物浓度的减少来表示 B、反应速率数值大的反应进行得一定快 C、对于可逆反应而言,物质的浓度不变时,反应一定达到了该条件下的限度 D、一定条件下,可逆反应达到最大限度时,反应没有停止4. 下列说法错误的是( )A、物质CaHAsO4中含有两种长周期元素 B、SiO2超分子纳米管(微观结构如图 )中存在共价键
C、新型原电池材料磷酸盐Li1﹣xFePO4中Fe显+2价
D、离子结构示意图为
)中存在共价键
C、新型原电池材料磷酸盐Li1﹣xFePO4中Fe显+2价
D、离子结构示意图为  的粒子能表示35Cl﹣或37Cl﹣
5. 将28g铁粉和16g硫粉混合堆放在石棉网上,用烧红的玻璃棒的一端接触混合物引发反应Fe(s)+S(s) FeS(s),移开玻璃棒后,反应保持红热状态剧烈进行至反应物完全反应。下列说法错误的是( )A、该反应是放热反应 B、若完成该反应需要1min,则该反应用S表示的反应速率v(S)=0.5mol⋅L﹣1⋅min﹣1 C、该反应在理论上可以设计成原电池反应 D、增加Fe的量,不能显著增大该反应的速率6. 科学家通过应用原子钟发现,2020年地球的自转速度是有记录以来最快的,同时还预测2021年白转速度还会加快。133Cs被普遍选作精细的原子钟(Cs有多种核素,如137Cs等),下列有关说法正确的是( )A、133Cs与137Cs的质子数相差4 B、金属性:Cs<Ba C、Cs的氧化物有两种 D、自然界中133Cs的含量固定不变7. 防控新冠肺炎疫情经常会用到各类消毒剂,下列对各类消毒剂的说法错误的是( )A、84消毒液的有效成分是NaClO,NaClO是离子化合物 B、75%酒精中乙醇的体积分数大于水的体积分数,乙醇是溶剂 C、H2O2中存在两种共价键 D、Cl2O所含元素的原子半径:Cl>O8. 现行元素周期表第七周期已经排满,下列关于元素周期表的说法正确的是( )A、ⅠA、ⅡA族的元素只能形成阳离子 B、元素周期表共18个纵行,只包括7个主族7个副族、1个0族 C、第三周期和第四周期的同主族元素的原子序数的差值为8或18 D、0族元素中所有原子的最外层电子数都是8,化学性质相对稳定9. 下列物质的制备或性质实验中,由现象得出的结论正确的是( )
的粒子能表示35Cl﹣或37Cl﹣
5. 将28g铁粉和16g硫粉混合堆放在石棉网上,用烧红的玻璃棒的一端接触混合物引发反应Fe(s)+S(s) FeS(s),移开玻璃棒后,反应保持红热状态剧烈进行至反应物完全反应。下列说法错误的是( )A、该反应是放热反应 B、若完成该反应需要1min,则该反应用S表示的反应速率v(S)=0.5mol⋅L﹣1⋅min﹣1 C、该反应在理论上可以设计成原电池反应 D、增加Fe的量,不能显著增大该反应的速率6. 科学家通过应用原子钟发现,2020年地球的自转速度是有记录以来最快的,同时还预测2021年白转速度还会加快。133Cs被普遍选作精细的原子钟(Cs有多种核素,如137Cs等),下列有关说法正确的是( )A、133Cs与137Cs的质子数相差4 B、金属性:Cs<Ba C、Cs的氧化物有两种 D、自然界中133Cs的含量固定不变7. 防控新冠肺炎疫情经常会用到各类消毒剂,下列对各类消毒剂的说法错误的是( )A、84消毒液的有效成分是NaClO,NaClO是离子化合物 B、75%酒精中乙醇的体积分数大于水的体积分数,乙醇是溶剂 C、H2O2中存在两种共价键 D、Cl2O所含元素的原子半径:Cl>O8. 现行元素周期表第七周期已经排满,下列关于元素周期表的说法正确的是( )A、ⅠA、ⅡA族的元素只能形成阳离子 B、元素周期表共18个纵行,只包括7个主族7个副族、1个0族 C、第三周期和第四周期的同主族元素的原子序数的差值为8或18 D、0族元素中所有原子的最外层电子数都是8,化学性质相对稳定9. 下列物质的制备或性质实验中,由现象得出的结论正确的是( )选项
实验
现象
结论
A
将铝丝和铜丝接触,并放入冷的浓硝酸中浸泡一段时间
铝丝上有红棕色气体产生
形成了原电池,且负极反应为Cu﹣2e﹣═Cu2+
B
向亚硫酸钠固体中加入浓硫酸,将产生的气体通入溴水中
溴水褪色
SO2具有漂白性
C
向某溶液中加入稀硝酸酸化的Ba(NO3)2溶液,再加入AgNO3溶液
开始无现象,后有沉淀生成
原溶液中一定含有Cl﹣
D
将盐酸和大理石反应生成的CO2气体直接通入Na2SiO3溶液中
产生白色沉淀
证明酸性:碳酸>硅酸
A、A B、B C、C D、D10. 将10mL 2mol•L﹣1盐酸注入①、②两个完全相同的装置(如图),然后迅速密封。下列叙述正确的是( ) A、CO2的生成速率:①>② B、若忽略温度变化,最终两气球体积:①>② C、①中发生反应的离子方程式是CO32﹣+2H+═CO2↑+H2O D、若溶液体积变化忽略不计,则最终两试管中Na+的物质的量浓度相等11. 下列说法正确的是( )A、放热反应中反应物的总能量小于生成物的总能量 B、将Mg、Al片用导线连接后放入氢氧化钠溶液中组成原电池,Al为负极,Mg为正极 C、由甲烷、空气和稀硫酸构成的燃料电池的正极反应是O2+4e﹣+2H2O═4OH﹣ D、充电电池可以无限制地反复放电、充电12. 一定温度下,在2L恒容密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示。下列叙述错误的是( )
A、CO2的生成速率:①>② B、若忽略温度变化,最终两气球体积:①>② C、①中发生反应的离子方程式是CO32﹣+2H+═CO2↑+H2O D、若溶液体积变化忽略不计,则最终两试管中Na+的物质的量浓度相等11. 下列说法正确的是( )A、放热反应中反应物的总能量小于生成物的总能量 B、将Mg、Al片用导线连接后放入氢氧化钠溶液中组成原电池,Al为负极,Mg为正极 C、由甲烷、空气和稀硫酸构成的燃料电池的正极反应是O2+4e﹣+2H2O═4OH﹣ D、充电电池可以无限制地反复放电、充电12. 一定温度下,在2L恒容密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示。下列叙述错误的是( ) A、0~2min内用表的平均反应速率v(A)=0.2mol•L﹣1•min﹣1 B、上述反应的化学方程式是2A(g)+B(g)⇌3C(g) C、2min时该反应达到平衡 D、v(A正 , 开始)<v(A正 , 2min)13. W、X、Y、Z是原子序数依次增大的短周期元素,W元素形成的一种微粒是质子,X、Y两种元素原子的最外层电子数之比为2:3,且X的一种核素可以测定文物的年代,Z所在的周期数和族序数相同。下列说法正确的是( )A、X、Z的最高价氧化物对应的水化物能发生反应 B、原子半径:X<Y<Z C、Y、Z形成的天然化合物是某种宝石的主要成分 D、原子最外层电子数:Z>Y>X14. 现有由Al2O3、SiO2、CuO、C、Fe中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去)。下列关于混合粉末的组成判断错误的是( )
A、0~2min内用表的平均反应速率v(A)=0.2mol•L﹣1•min﹣1 B、上述反应的化学方程式是2A(g)+B(g)⇌3C(g) C、2min时该反应达到平衡 D、v(A正 , 开始)<v(A正 , 2min)13. W、X、Y、Z是原子序数依次增大的短周期元素,W元素形成的一种微粒是质子,X、Y两种元素原子的最外层电子数之比为2:3,且X的一种核素可以测定文物的年代,Z所在的周期数和族序数相同。下列说法正确的是( )A、X、Z的最高价氧化物对应的水化物能发生反应 B、原子半径:X<Y<Z C、Y、Z形成的天然化合物是某种宝石的主要成分 D、原子最外层电子数:Z>Y>X14. 现有由Al2O3、SiO2、CuO、C、Fe中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去)。下列关于混合粉末的组成判断错误的是( ) A、“过量某浓酸”可能是浓硝酸 B、M是SiO2 C、混合粉末中一定含有CuO、C D、“两种气体”遇水一定发生氧化还原反应15. 某新型电池的工作原理如图所示,已知电池放电时的反应为Na1﹣xMnO2+NaxCn═NaMnO2+nC(反应前后C的化合价不变)。下列说法错误的是( )
A、“过量某浓酸”可能是浓硝酸 B、M是SiO2 C、混合粉末中一定含有CuO、C D、“两种气体”遇水一定发生氧化还原反应15. 某新型电池的工作原理如图所示,已知电池放电时的反应为Na1﹣xMnO2+NaxCn═NaMnO2+nC(反应前后C的化合价不变)。下列说法错误的是( ) A、电极M是电池的正极 B、电池的负极发生反应Na﹣e﹣═Na+ C、电池工作时,Na+移向电极M D、电池工作时,电流由电极M经负载流向电极N16. 五种短周期主族元素a、b、c、d、e在周期表中的相对位置如表所示,下列说法错误的是( )
A、电极M是电池的正极 B、电池的负极发生反应Na﹣e﹣═Na+ C、电池工作时,Na+移向电极M D、电池工作时,电流由电极M经负载流向电极N16. 五种短周期主族元素a、b、c、d、e在周期表中的相对位置如表所示,下列说法错误的是( )a
b
c
d
e
A、五种元素可能都是非金属元素 B、五种元素原子的最外层电子数之和可能为30 C、若a的一种单质是自然界最硬的物质,则五种元素中最高价氧化物的水化物为强酸的只有e D、若五种元素中只有一种是金属元素,则c的最高价氧化物的水化物能与其简单氢化物反应二、非选择题:本题共5小题,共52分。
-
17. 短周期主族元素A、B、C、D、E的原子序数依次增大,其原子半径和原子最外层电子数之间的关系如图所示。回答下列问题:
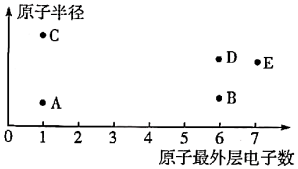 (1)、B在元素周期表中的位置为;A、B组成的原子个数比为1:1的化合物的电子式为。(2)、B、C的简单离子中半径较大的是(填离子符号)A、B、C三种元素组成的化合物中含有的化学键类型是。(3)、C、E的最高价氧化物对应的水化物反应的离子方程式为。(4)、下列叙述能说明E的非金属性强于D的是(填序号)。
(1)、B在元素周期表中的位置为;A、B组成的原子个数比为1:1的化合物的电子式为。(2)、B、C的简单离子中半径较大的是(填离子符号)A、B、C三种元素组成的化合物中含有的化学键类型是。(3)、C、E的最高价氧化物对应的水化物反应的离子方程式为。(4)、下列叙述能说明E的非金属性强于D的是(填序号)。a.E的简单氢化物的稳定性比D的强
b.D的氧化物对应的水化物的酸性比E的弱
c.D的单质常温下为固体,E的单质常温下为气体
d.将E的单质通入D的简单氢化物的水溶液中,有D的单质生成
18. 氢气是未来理想的能源。(1)、实验室用铁与2mol⋅L﹣1的硫酸反应生成H2的物质的量与反应时间的关系如图所示。按要求回答下列问题。①产生H2的平均反应速率最大的时间段是(填“0~2min”“2~4min”或“4~6min”),该时间段内对反应速率起关键作用的影响因素是。
②若向体系中加入少量硫酸铜溶液,可以加快氢气的生成速率,其原因是。
③要加快上述实验中产生氢气的速率,还可采取的措施是(填一种)。
(2)、工业上用海水制氢气的新技术的原理为2H2O 2H2↑+O2↑。回答下列问题:①分解海水的反应属于“反应(填“放热”或“吸热”)。
②分解产生的氢气储存比较困难,有一种储存方法的原理可表示为NaHCO3+H2 HCOONa+H2O。下列说法正确的是(填序号)。
A.储氢、释氢过程中均有能量变化
B.储氢时反应物中只有离子键、非极性键的断裂
C.储氢过程中,NaHCO3被还原
D.释氢过程中,每消耗0.1molH2O放出2.24LH2
(3)、H2可与I2发生反应:I2(g)+H2(g)⇌2HI(g)。一定温度下,在恒容密闭容器中进行该反应,下列叙述能说明该反应达到平衡的是 。(填序号)A、2v(H2)=v(HI) B、断裂1molH﹣H键的同时形成1molI﹣I键 C、容器内气体的压强不变 D、容器内气体的颜色不变 19. 为检验FeSO4•7H2O晶体在加热条件下发生反应后的气体产物,某同学设计如图装置。回答下列问题:
19. 为检验FeSO4•7H2O晶体在加热条件下发生反应后的气体产物,某同学设计如图装置。回答下列问题: (1)、配平反应FeSO4•7H2O Fe2O3+SO2↑+SO3↑+H2O↑:。(2)、固体B是(填药品名称,下同),溶液X是。(3)、装置接口的连接顺序是a→→h→i。(4)、利用装置丙可以确认的气体产物是。(填化学式)(5)、设计实验证明完全反应后装置甲中剩余的固体是Fe2O3:取量粉末加入足量稀硫酸中,将所得溶液分为两份,向其中一份溶液中滴加溶液,观察到的现象是;向另一份溶液中滴加酸性高锰酸钾溶液,观察到的现象是 , 则可证明所得固体是Fe2O3。20. 能量转化是化学变化的主要特征之一,按要求回答下列问题。(1)、页岩气是从页岩层中开采出来的天然气,成分以甲烷为主,页岩气的资源潜力可能大于常规天然气。下列有关页岩气的叙述错误的是 (填序号)。A、页岩气属于新能源 B、页岩气和氧气的反应是放热反应 C、甲烷中每个原子的最外层电子排布都达到8电子稳定结构 D、页岩气可以作燃料电池的负极燃料(2)、有关的电池装置如下:
(1)、配平反应FeSO4•7H2O Fe2O3+SO2↑+SO3↑+H2O↑:。(2)、固体B是(填药品名称,下同),溶液X是。(3)、装置接口的连接顺序是a→→h→i。(4)、利用装置丙可以确认的气体产物是。(填化学式)(5)、设计实验证明完全反应后装置甲中剩余的固体是Fe2O3:取量粉末加入足量稀硫酸中,将所得溶液分为两份,向其中一份溶液中滴加溶液,观察到的现象是;向另一份溶液中滴加酸性高锰酸钾溶液,观察到的现象是 , 则可证明所得固体是Fe2O3。20. 能量转化是化学变化的主要特征之一,按要求回答下列问题。(1)、页岩气是从页岩层中开采出来的天然气,成分以甲烷为主,页岩气的资源潜力可能大于常规天然气。下列有关页岩气的叙述错误的是 (填序号)。A、页岩气属于新能源 B、页岩气和氧气的反应是放热反应 C、甲烷中每个原子的最外层电子排布都达到8电子稳定结构 D、页岩气可以作燃料电池的负极燃料(2)、有关的电池装置如下:电池装置




编号
a
b
c
d
①上述四种电池中,属于二次电池的是(填序号,下同),属于干电池的是。
②a装置中,外电路中电子的流向是。(填“从Zn流向Cu”或“从Cu流向Zn”)
③装置中,若电解质改为碱性介质,则负极的电极反应式为。
(3)、氧化还原反应一般可以设计成原电池。若将反应Fe+2Fe3+═3Fe2+设计成原电池,则:①该电池的电解质溶液可以是。
②当外电路中转移1mole﹣时,电解质溶液增加的质量是g。
21. 图为工业合成氨的流程图,请回答下列有关问题。 (1)、N2的电子式为;氨除可以作化肥外,还可用作。(2)、“再循环物质”中的物质为。(填化学式)(3)、已知断裂1mol下列化学键需要的能量如下表。
(1)、N2的电子式为;氨除可以作化肥外,还可用作。(2)、“再循环物质”中的物质为。(填化学式)(3)、已知断裂1mol下列化学键需要的能量如下表。化学键
H﹣H
N﹣H
N≡N
能量
436kJ
391kJ
946kJ
生成1molNH3时,合成氨反应(填“吸收”或“放出”)的能量是kJ。
(4)、在一定条件下,将一定量的H2和N2置于一容积为2L的恒容密闭容器中发生反应,反应过程中H2、N2和NH3的物质的量变化如图所示。
①反应开始10min内,N2的平均反应速率为。
②下列判断正确的是。(填序号)
A.tmin时正、逆反应速率相等
B.Z曲线表示NH3的物质的量随时间变化的情况
C.0~10min内v(H2)= v(NH3)
D.10~20min内的反应速率比0~10min内的反应速率大
③25min时,改变的一种条件是。