浙江省台州市2021年高考化学二模试卷
试卷更新日期:2021-06-10 类型:高考模拟
一、单选题
-
1. 下列只含离子键的盐是( )A、 B、 C、KClO D、2. 结晶操作中需要用到的仪器是( )A、
 B、
B、 C、
C、 D、
D、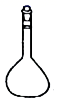 3. 下列物质属于非电解质的是( )A、 B、 C、 D、4. 下列物质对应的组成正确的是( )A、丙氨酸: B、水晶:Si C、绿矾: D、熟石灰:5. 下列表示正确的是( )A、氨气的电子式:
3. 下列物质属于非电解质的是( )A、 B、 C、 D、4. 下列物质对应的组成正确的是( )A、丙氨酸: B、水晶:Si C、绿矾: D、熟石灰:5. 下列表示正确的是( )A、氨气的电子式: B、乙炔分子的球棍模型:
B、乙炔分子的球棍模型:  C、2-丁烯的键线式:
C、2-丁烯的键线式:  D、硝基苯的结构简式:
D、硝基苯的结构简式:  6. 下列说法错误的是( )A、乙烯可用作水果的催熟剂 B、己烷可用作碘水中提取碘的萃取剂 C、蔗糖可用作食品的调味剂 D、福尔马林可用作食品的保鲜剂7. 下列说法正确的是( )A、互为同位素的气、氘、氚可通过化学反应相互转化 B、 甲基丙烷和异丁烷互为同系物,化学性质相似 C、甲酸甲酯和乙酸互为同分异构体,化学性质不同 D、富勒烯与金刚石互为同素异形体,物理性质相似8. 下列说法正确的是( )A、工业上以氯气和石灰水为原料生产漂白粉 B、在浓氨水的作用下,加热甲醛和苯酚,反应得到酚醛树脂 C、 溶液中滴加足量的氨水会产生白色沉淀,但沉淀不溶解 D、硝化甘油、火棉、TNT均是硝酸发生酯化反应后的产物9. 下列说法错误的是( )A、分子筛常用于分离、提纯气体混合物,但不能用于液体混合物分离 B、 可用作医疗上检查肠胃的钡餐,还可用作白色颜料 C、光照下, 在空气中与碳氢化合物发生作用,可产生光化学烟雾 D、铁的化合物应用广泛, 常用作净水剂10. 已知: ,下列说法正确的是( )A、 是氧化剂 B、HIO得电子,发生氧化反应 C、该反应的氧化产物与还原产物的物质的量之比为1:2 D、通过该反应可说明HIO的氧化性强于11. 下列说法错误的是( )A、向 和 ,固体中分别滴加几滴水,可通过温度变化鉴别两者 B、将火柴头没入水中,片刻后取少量溶液于试管中,滴加硝酸银和稀硝酸可检验其中的氯元素 C、将镀锌铁皮放入稀硫酸,待产生氢气的速率突然减小,可以判断锌镀层已反应完全 D、可以先用甘油洗,再用水洗的方法处理受溴腐蚀致伤的伤口12. 下列说法错误的是( )A、 均可通过化合反应生成 B、用惰性电极分别电解 溶液,均为电解水 C、将 气体分别通入紫色石蕊试液中,均出现溶液先变红后褪色 D、将铁片和铝片置于冷的浓硝酸中均发生钝化13. 下列说法正确的是( )A、生活中常见的有机玻璃、合成橡胶、聚四氟乙烯等都是通过加聚反应得到 B、人体摄入的油脂、淀粉、葡萄糖、蛋白质必须经过水解才能吸收 C、利用煤的干馏将煤中含有的苯、甲苯提取出来 D、石油气、天然气、沼气等不可再生能源,完全燃烧主要产物均为 和14. 下列离子组能大量共存且加入(或通入)试剂发生反应的离子方程式正确的是( )
6. 下列说法错误的是( )A、乙烯可用作水果的催熟剂 B、己烷可用作碘水中提取碘的萃取剂 C、蔗糖可用作食品的调味剂 D、福尔马林可用作食品的保鲜剂7. 下列说法正确的是( )A、互为同位素的气、氘、氚可通过化学反应相互转化 B、 甲基丙烷和异丁烷互为同系物,化学性质相似 C、甲酸甲酯和乙酸互为同分异构体,化学性质不同 D、富勒烯与金刚石互为同素异形体,物理性质相似8. 下列说法正确的是( )A、工业上以氯气和石灰水为原料生产漂白粉 B、在浓氨水的作用下,加热甲醛和苯酚,反应得到酚醛树脂 C、 溶液中滴加足量的氨水会产生白色沉淀,但沉淀不溶解 D、硝化甘油、火棉、TNT均是硝酸发生酯化反应后的产物9. 下列说法错误的是( )A、分子筛常用于分离、提纯气体混合物,但不能用于液体混合物分离 B、 可用作医疗上检查肠胃的钡餐,还可用作白色颜料 C、光照下, 在空气中与碳氢化合物发生作用,可产生光化学烟雾 D、铁的化合物应用广泛, 常用作净水剂10. 已知: ,下列说法正确的是( )A、 是氧化剂 B、HIO得电子,发生氧化反应 C、该反应的氧化产物与还原产物的物质的量之比为1:2 D、通过该反应可说明HIO的氧化性强于11. 下列说法错误的是( )A、向 和 ,固体中分别滴加几滴水,可通过温度变化鉴别两者 B、将火柴头没入水中,片刻后取少量溶液于试管中,滴加硝酸银和稀硝酸可检验其中的氯元素 C、将镀锌铁皮放入稀硫酸,待产生氢气的速率突然减小,可以判断锌镀层已反应完全 D、可以先用甘油洗,再用水洗的方法处理受溴腐蚀致伤的伤口12. 下列说法错误的是( )A、 均可通过化合反应生成 B、用惰性电极分别电解 溶液,均为电解水 C、将 气体分别通入紫色石蕊试液中,均出现溶液先变红后褪色 D、将铁片和铝片置于冷的浓硝酸中均发生钝化13. 下列说法正确的是( )A、生活中常见的有机玻璃、合成橡胶、聚四氟乙烯等都是通过加聚反应得到 B、人体摄入的油脂、淀粉、葡萄糖、蛋白质必须经过水解才能吸收 C、利用煤的干馏将煤中含有的苯、甲苯提取出来 D、石油气、天然气、沼气等不可再生能源,完全燃烧主要产物均为 和14. 下列离子组能大量共存且加入(或通入)试剂发生反应的离子方程式正确的是( )选项
离子组
试剂
离子方程式
A
足量Cu粉
B
少量Cl2
C
少量
D
足量NaOH溶液
A、A B、B C、C D、D15. 已知尼泊金酯和香兰素的结构简式,下列说法错误的是( )尼泊金酯:
 香兰素:
香兰素:  A、一定条件下,两者都能发生取代反应 B、两者均能与NaOH溶液发生水解反应 C、等质量的尼泊金酯和香兰素完全燃烧,耗氧量相同 D、两者均能与 溶液发生显色反应16. 短周期元素X、Y、Z、W、Q的原子序数依次增大,X与Q同主族且原子序数之和为20,W的最外层电子数等于其电子层数,Y与Z的最外层电子数之和为8,下列说法错误的是( )A、X的氢化物分子空间构型不一定是正四面体 B、Q的最高价氧化物既能与某些酸反应,又能与碱反应 C、Y与Z形成的化合物一定是离子化合物 D、单质W制成的器皿可长时间盛放咸菜等腌制品17. 25℃,下列说法正确的是( )A、某溶液由水电离出 为 ,则该溶液可能是酸,也可能是盐 B、将pH=3的 加水稀释10倍,测得pH为4.则可证明 为强酸 C、测NaHA溶液的pH,若 ,则 是弱酸;若 ,则 是强酸 D、同浓度、体积之比为1∶2的 溶液和NaOH溶液恰好完全反应,可证明 是强酸18. NA为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,1个N2分子的体积为 B、电解 溶液后,要加入 恢复电解前状态,则电解中转移电子数为0.2NA C、将 溶于稀氨水配成1L溶液,所得溶液呈中性,则溶液中 数目为NA D、合成氨反应中,当2NA个H-H断裂,同时有NA个N-H断裂,则反应达到最大限度19. 温度下,向2L真空密闭容器中加入 固体,发生反应: (未配平),反应过程如图,下列说法正确的是( )
A、一定条件下,两者都能发生取代反应 B、两者均能与NaOH溶液发生水解反应 C、等质量的尼泊金酯和香兰素完全燃烧,耗氧量相同 D、两者均能与 溶液发生显色反应16. 短周期元素X、Y、Z、W、Q的原子序数依次增大,X与Q同主族且原子序数之和为20,W的最外层电子数等于其电子层数,Y与Z的最外层电子数之和为8,下列说法错误的是( )A、X的氢化物分子空间构型不一定是正四面体 B、Q的最高价氧化物既能与某些酸反应,又能与碱反应 C、Y与Z形成的化合物一定是离子化合物 D、单质W制成的器皿可长时间盛放咸菜等腌制品17. 25℃,下列说法正确的是( )A、某溶液由水电离出 为 ,则该溶液可能是酸,也可能是盐 B、将pH=3的 加水稀释10倍,测得pH为4.则可证明 为强酸 C、测NaHA溶液的pH,若 ,则 是弱酸;若 ,则 是强酸 D、同浓度、体积之比为1∶2的 溶液和NaOH溶液恰好完全反应,可证明 是强酸18. NA为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,1个N2分子的体积为 B、电解 溶液后,要加入 恢复电解前状态,则电解中转移电子数为0.2NA C、将 溶于稀氨水配成1L溶液,所得溶液呈中性,则溶液中 数目为NA D、合成氨反应中,当2NA个H-H断裂,同时有NA个N-H断裂,则反应达到最大限度19. 温度下,向2L真空密闭容器中加入 固体,发生反应: (未配平),反应过程如图,下列说法正确的是( ) A、X可能为 B、 用 表示的反应速率为 C、第2min时逆反应速率大于第4min时逆反应速率 D、第4min时,保持温度和容积不变,向容器中再加入 ,混合气体颜色加深20. 已知:295K时,相关物质的相对能量如下表。下列说法错误的是( )
A、X可能为 B、 用 表示的反应速率为 C、第2min时逆反应速率大于第4min时逆反应速率 D、第4min时,保持温度和容积不变,向容器中再加入 ,混合气体颜色加深20. 已知:295K时,相关物质的相对能量如下表。下列说法错误的是( )物质
相对能量(kJ/mol)
52
0
0
0
-84
-110
-393
-242
-286
A、由表中数据, 的标准燃烧热为 B、 C、 和 的键能之和大于 的键能 D、将碳先转化为水煤气再燃烧与直接燃烧等量的碳,两个过程的热效应是一样的21. 某小组探究 溶液和酸化的 溶液的反应过程,装置如下。K闭合后,电流表的指针偏转情况如下表:表盘


时间
偏转右偏
右偏至Y
指针回到“0”处,又返至“X”处;如此周期性往复多次……
指针归零
若往酸化的 溶液中加少量KI溶液,再闭合K,指针只在“0”到“X”处往返。下列说法错误的是:( )
A、K闭合后,取b极区溶液加入盐酸酸化的 溶液,有白色沉淀生成 B、 时,a极的电极反应式为: C、 时指针回到“0”处是因为溶液中 ;已反应完全 D、 时指针返回X处时a极的电极反应式为:22. 时,向一定浓度的 溶液中滴加 的NaOH溶液,混合溶液中pH与 的关系如图所示。下列说法错误的是( ) A、 代表pH和 的关系 B、当溶液中 时,溶液可能呈酸性 C、室温下,若 ,则 D、 上的所有点对应溶液中水的电离程度一定大于直线23. 某小组用温度传感器探究液态物质挥发过程中体系温度变化的大小和快慢。如图a连接装置,将滤纸固定于温度传感器测量端,并插入待测液中使滤纸吸附待测液,待温度示数稳定后,开始采集数据,约10s后取出温度传感器置于空气中放置,采集到的温度变化如图b、图c所示。下列说法错误的是:( )
A、 代表pH和 的关系 B、当溶液中 时,溶液可能呈酸性 C、室温下,若 ,则 D、 上的所有点对应溶液中水的电离程度一定大于直线23. 某小组用温度传感器探究液态物质挥发过程中体系温度变化的大小和快慢。如图a连接装置,将滤纸固定于温度传感器测量端,并插入待测液中使滤纸吸附待测液,待温度示数稳定后,开始采集数据,约10s后取出温度传感器置于空气中放置,采集到的温度变化如图b、图c所示。下列说法错误的是:( )
 A、由图b,分子间作用力越弱,气化速率越快 B、由图c,正丁醇气化温差小于乙醚,是因为正丁醇更稳定 C、由图d,X的相对分子量可能小于Y D、由图d,X、Y可以分别为正己烷、正戊烷24. 固体混合物X含有 中的几种,进行如下实验:
A、由图b,分子间作用力越弱,气化速率越快 B、由图c,正丁醇气化温差小于乙醚,是因为正丁醇更稳定 C、由图d,X的相对分子量可能小于Y D、由图d,X、Y可以分别为正己烷、正戊烷24. 固体混合物X含有 中的几种,进行如下实验:①X溶于足量水,得到无色溶液Y和沉淀Z;
②往沉淀Z中加足量稀盐酸,沉淀部分溶解。
下列说法错误的是( )
A、X中肯定含有 和 B、往溶液Y中加稀硫酸,若产生黄绿色气体,则X中含有 C、往溶液Y中通 ,不一定生成白色沉淀 D、往沉淀Z中加NaOH溶液,若沉淀部分溶解,则X中含有25. 下列方案设计、现象和结论都正确的是( )目的
方案设计
现象或结论
A
探究浓度对速率的影响
用两支试管各取 酸性 溶液,分别加入5滴 和5滴 溶液
两试管溶液均褪为无色,且加 溶液褪色更快
B
探究反应: 的热效应
取少量 于试管中,逐滴加浓盐酸至晶体完全溶解,再滴加水至溶液呈紫色。将紫色溶液分装于三支试管中,分别置于热水、冰水和室温下
置于热水中的溶液呈蓝色,置于冰水中的溶液呈粉红色,则正反应为吸热反应
C
纸层析法分离 和
将点有试样点的滤纸条末端浸入展开剂中(试样点未接触展开剂),一段时间后取出滤纸条进行氨熏
滤纸表面有红棕色(上)和蓝色(下)斑痕,说明 在流动相中分配得多
D
制备铜氨纤维
将脱脂棉加入铜氨溶液,搅拌使之形成黏稠液,用注射器将黏稠液注入稀NaOH溶液中。
取出生成物,用水洗涤得到白色的铜氨纤维
A、A B、B C、C D、D二、综合题
-
26.(1)、多硫化钠( )是一系列含多硫离子的化合物,有 等,各原子均满足 稳定结构,其中 的电子式是。(2)、水因质子自递( )能导电,无水硫酸也能导电,其原因是(用化学用语表示)。(3)、青蒿素结构如图,只能在低温条件下萃取青滿索是因其分子中的某个基团对热不稳定,且该基团能与NaI反应生成 。该基团的结构式为。
 27. 为确定某碱式碳酸镁 的组成,某同学取23.3g样品置于硬质玻璃管中充分灼烧至恒重,残留固体质量为10.0g,将产生的气体先通过足量98%的浓硫酸( 为 ),再通过足量的碱石灰,碱石灰质量增加8.8g。请计算:(1)、98%的硫酸溶液物质的量浓度是;(2)、根据实验测定的数据,求出碱式碳酸镁化学式中X、Y、Z的比值(要求写出计算过程)。28. 由三种元素组成的化合物X,按如下流程进行实验。气体A是由气体E和气体F组成的混合物,溶液B可被 溶液恰好中和。
27. 为确定某碱式碳酸镁 的组成,某同学取23.3g样品置于硬质玻璃管中充分灼烧至恒重,残留固体质量为10.0g,将产生的气体先通过足量98%的浓硫酸( 为 ),再通过足量的碱石灰,碱石灰质量增加8.8g。请计算:(1)、98%的硫酸溶液物质的量浓度是;(2)、根据实验测定的数据,求出碱式碳酸镁化学式中X、Y、Z的比值(要求写出计算过程)。28. 由三种元素组成的化合物X,按如下流程进行实验。气体A是由气体E和气体F组成的混合物,溶液B可被 溶液恰好中和。 请回答:(1)、组成X的三种元素是(真元素符号),X的化学式是。(2)、步骤I发生反应的离子方程式是。(3)、Mg在气体E中剧烈燃烧生成两种固体化合物,该反应的化学方程式是。(4)、步骤II,为使铜片进一步溶解,可向反应后的混合物中加入(填序号)。
请回答:(1)、组成X的三种元素是(真元素符号),X的化学式是。(2)、步骤I发生反应的离子方程式是。(3)、Mg在气体E中剧烈燃烧生成两种固体化合物,该反应的化学方程式是。(4)、步骤II,为使铜片进一步溶解,可向反应后的混合物中加入(填序号)。①稀 ② ③ ④
(5)、将体积比为 的气体E和 的混合气体通入水中制得Y的浓溶液。该浓溶液与Cu反应得到绿色溶液,有同学认为溶液呈绿色是因为溶有气体E,设计实验方案证明。29. 探究含碳化合物的转化,有一定的现实意义。(1)、①溶于海水的 以 形式存在。在海洋中,通过如图钙化作用实现碳自净。写出钙化作用的离子方程式。
②利用氨水作吸收液生成 ,是当前有效捕捉 的方法之一、下列有关说法错误的是
A.该方法的优势在于生成的 易分解,可实现吸收液的再生
B. 溶液中存在
C. 溶液中存在
D.已知 ,可推测 溶液呈酸性
(2)、利用反应 ,制备重要的化工原料甲醇,在一定条件下进行该反应,测得 的转化率与温度(T)、起始投料比(m)关系如图。
①下列描述正确的是。
A.若 ,则 最大
B.在 前, ,在 时,
C.若 ,则a点 的平衡转化率等于 的平衡转化率
D.若反应一段时间后 和 的体积分数相同可判断上述反应达平衡
②图中在 时,不同的投料比 转化率趋于相近的原因是。
(3)、以 、 为原料催化重整可得到合成气: ;①在t℃下,向2L恒容的密闭容器中充入 和 进行催化重整反应,平衡后测得 和CO的体积分数相等,则t℃下该反应的平衡常数。
②催化重整时,催化剂活性会因积碳增多而降低,有关积碳和消碳反应如下:
积碳反应:
消碳反应:
在一定的温度下,增大 的浓度,有助于增大催化剂活性的原因是。
30. 某兴趣小组用硼镁矿(主要成分为 ,含 等杂质)联产 和 ,流程如下: 已知: 是一种极弱的酸,可溶于水、乙醇; 易溶于水,微溶于乙醇;相关物质的溶解度随温度变化如图。
已知: 是一种极弱的酸,可溶于水、乙醇; 易溶于水,微溶于乙醇;相关物质的溶解度随温度变化如图。
请回答:
(1)、步骤I,为加快浸取速率,除适当提高硫酸浓度,还可采取的措施有(任写一种)。(2)、步骤II, 加过量的原因除尽可能将 氧化完全,还可能是。(3)、下列说法正确的是___________。A、步骤II,试剂a可选择 B、步骤III,煮沸的主要目的是除去没反应完的 及其中溶解的 C、步骤III,操作a宜采用热过滤 D、步骤IV,用玻璃棒摩擦器壁,促进晶体析出 E、步骤V,晶体置于烘箱中高温烘干(4)、步骤VI,采用浮选工艺有效分离颗粒大小不同的 晶体和 晶体,从下列选项中选出合理的操作:。 a.减压蒸发溶剂;
a.减压蒸发溶剂;b.加压蒸发溶剂;
c.用布氏漏斗抽滤;
d.用普通漏斗过滤;
e.蒸发至溶液出现晶膜,停止加热;
f.蒸发至溶液中出现大量晶体,停止加热;
g.冷水洗涤;
h.乙醇洗涤;
i.冷却至室温。
(5)、 纯度的测定:准确称取制得的晶体试样mg溶于水中,加入足量甘露醇,摇匀后配制成100mL溶液,取25.00mL于锥形瓶中,用酚酞试液作指示剂,用cmol/LNaOH标准液滴定至终点,消耗NaoH溶液VmL。已知:i. 与NaOH溶液发生的反应为:
ii. 与甘露醇等多羟基化合物形成稳定的络合物,增大其电离度。
2
 +
+  +H++3H2O
+H++3H2O① 不能直接用NaOH溶液滴定的原因是。
② 的纯度为(用含字母的式子表示)。
31. 某课题组利用苯和烃A合成有机中间体M。其合成路线如下:
已知:
①
②

③
 +2CH3CH2OH→
+2CH3CH2OH→ 
请回答:
(1)、下列说法正确的是___________A、C→D的反应类型是取代反应 B、可以用新制的 悬浊液鉴别 C、A、B都能使溴水发生褪色,其褪色原理相同 D、化合物M的分子式是(2)、化合物E的结构简式是;化合物I的结构简式是。(3)、写出G→H的化学方程式。(4)、写出符合下列条件的F的同分异构体的结构简式。① 谱和IR谱检测表明分子中共有4种氢原子,无 和碳碳叁键;
②除苯环外无其它环。
(5)、以 和 为原料,设计制备 的合成路线(用流程图表示;无机试剂任选)。