浙江省金华市义乌市2021年高考化学模拟试卷
试卷更新日期:2021-06-10 类型:高考模拟
一、单选题
-
1. 有共价键的盐是( )A、NaClO B、Mg3N2 C、CaCl2 D、NaOH2. 下列仪器中名称正确的是( )




A.泥三角
B.长颈漏斗
C.溶量瓶
D.镊子
A、A B、B C、C D、D3. 下列属于强电解质的有机物是( )A、甘油 B、硬脂酸钠 C、苯酚 D、液态HCl4. 已知:8NH3+3Cl2=6NH4Cl+N2 , 下列说法错误的是( )A、该反应的氧化产物为 N2 B、Cl2 得电子,发生还原反应 C、该反应的氧化剂与还原剂微粒个数之比为 3∶8 D、通过该反应可说明 Cl2 的氧化性强于 N25. 下列物质的名称错误的是( )A、熟石膏:2CaSO4·H2O B、重晶石:BaSO4 C、刚玉:SiO2 D、草酸:HOO-COOH6. 下列有关化学用语的表示正确的是( )A、 的结构示意图: B、乙炔的比例模型
B、乙炔的比例模型  C、中子数为18的硫原子:
D、CaH2的电子式:
C、中子数为18的硫原子:
D、CaH2的电子式:  7. 下列说法正确的是( )A、过氧乙酸(CH3COOOH)与羟基乙酸(HOCH2COOH)互为同分异构体 B、乙烯与聚乙烯互为同系物 C、 与 互为同位素 D、H216O、D216O、H218O、D218O互为同素异形体8. 下列说法正确的是( )A、麒麟9905G芯片己正式发布,其主要成分为SiO2 B、碳酸钠能与盐酸反应,可用于治疗胃酸过多 C、在船身上装有锌块,是利用了牺牲阳极的阴极保护法保护船体 D、明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒9. 下列关于物质性质说法合理的是( )A、 、 、 均可以由相应单质直接化合生成 B、浓盐酸、浓硝酸、浓硫酸均可用铝罐车运输 C、等质量的铜分别与足量的浓硝酸和稀硝酸充分反应,转移的电子数相等 D、将氯气通入紫色石蕊溶液中,溶液先变红后褪色,说明氯气具有漂白性和酸性10. 下列说法正确的是( )A、煤的气化就是将煤在高温条件由固态转化为气态是物理变化过程 B、蔗糖与麦芽糖互为同分异构体,前者不能发生银镜反应,而后者可以。 C、棉、麻、纸张、丝绸的主要成分均为天然纤维素,属于高分子化合物 D、合成抑制新冠病毒(COVID-19)的潜在药物磷酸氯喹的中间体
7. 下列说法正确的是( )A、过氧乙酸(CH3COOOH)与羟基乙酸(HOCH2COOH)互为同分异构体 B、乙烯与聚乙烯互为同系物 C、 与 互为同位素 D、H216O、D216O、H218O、D218O互为同素异形体8. 下列说法正确的是( )A、麒麟9905G芯片己正式发布,其主要成分为SiO2 B、碳酸钠能与盐酸反应,可用于治疗胃酸过多 C、在船身上装有锌块,是利用了牺牲阳极的阴极保护法保护船体 D、明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒9. 下列关于物质性质说法合理的是( )A、 、 、 均可以由相应单质直接化合生成 B、浓盐酸、浓硝酸、浓硫酸均可用铝罐车运输 C、等质量的铜分别与足量的浓硝酸和稀硝酸充分反应,转移的电子数相等 D、将氯气通入紫色石蕊溶液中,溶液先变红后褪色,说明氯气具有漂白性和酸性10. 下列说法正确的是( )A、煤的气化就是将煤在高温条件由固态转化为气态是物理变化过程 B、蔗糖与麦芽糖互为同分异构体,前者不能发生银镜反应,而后者可以。 C、棉、麻、纸张、丝绸的主要成分均为天然纤维素,属于高分子化合物 D、合成抑制新冠病毒(COVID-19)的潜在药物磷酸氯喹的中间体 (喹啉),和联苯、多苯代脂烃,均属于芳香烃
11. 下列有关实验说法中,错误的是( )A、利用纸层析法分离Fe3+、Cu2+时,氨熏显色后上方出现红棕色斑点,下方出现深蓝色斑点 B、可用AgNO3溶液和稀HNO3区分NaCl、NaNO2和NaNO3 C、在“镀锌铁皮的镀层厚度的测定”实验中,将镀锌铁皮放入稀硫酸,待产生气泡的速率显著减小时,可以判断锌镀层已反应完全 D、溶质的溶解度小,溶液的浓度高,可析出较大晶粒12. 类推是化学学习和研究中常用的思维方法,下列类推正确的是( )A、晶体中有阴离子,必有阳离子,则晶体中有阳离子,也必有阴离子 B、CuSO4溶液在空气中蒸干得到CuSO4固体,故Fe2(SO4)3溶液在空气中蒸干得到Fe2(SO4)3固体 C、适量CO2通入Ca(ClO)2溶液中可生成CaCO3和HClO,故适量SO2通入Ca(ClO)2溶液中可生成CaSO3和HClO D、Fe和S反应生成FeS,则Cu和S反应生成CuS13. 能正确表示下列变化的离子方程式是( )A、向Ca(HCO)2溶液中加入足量Ca(OH)2溶液: B、泡沫灭火器原理: C、过量铁粉与稀硝酸反应: D、纯碱溶液显碱性的原因:14. 下列说法错误的是( )A、可用NaOH溶液除去苯中混有的苯酚 B、将乙醇与Al2O3共热可产生使Br2的四氯化碳溶液褪色的气体 C、向淀粉的水解液中加入碘水,溶液变蓝,说明淀粉未水解 D、氨基酸以两性离子的形态存在时,水中溶解度最小,可以形成晶体析出15. 2020年3月24日,中国工程院院士、天津中医药大学校长张伯礼表示,中成药连花清瘟胶囊对于治疗轻型和普通型的新冠肺炎有确切的疗效。其有效成分绿原酸的结构简式如图,下列有关绿原酸说法正确的是( )
(喹啉),和联苯、多苯代脂烃,均属于芳香烃
11. 下列有关实验说法中,错误的是( )A、利用纸层析法分离Fe3+、Cu2+时,氨熏显色后上方出现红棕色斑点,下方出现深蓝色斑点 B、可用AgNO3溶液和稀HNO3区分NaCl、NaNO2和NaNO3 C、在“镀锌铁皮的镀层厚度的测定”实验中,将镀锌铁皮放入稀硫酸,待产生气泡的速率显著减小时,可以判断锌镀层已反应完全 D、溶质的溶解度小,溶液的浓度高,可析出较大晶粒12. 类推是化学学习和研究中常用的思维方法,下列类推正确的是( )A、晶体中有阴离子,必有阳离子,则晶体中有阳离子,也必有阴离子 B、CuSO4溶液在空气中蒸干得到CuSO4固体,故Fe2(SO4)3溶液在空气中蒸干得到Fe2(SO4)3固体 C、适量CO2通入Ca(ClO)2溶液中可生成CaCO3和HClO,故适量SO2通入Ca(ClO)2溶液中可生成CaSO3和HClO D、Fe和S反应生成FeS,则Cu和S反应生成CuS13. 能正确表示下列变化的离子方程式是( )A、向Ca(HCO)2溶液中加入足量Ca(OH)2溶液: B、泡沫灭火器原理: C、过量铁粉与稀硝酸反应: D、纯碱溶液显碱性的原因:14. 下列说法错误的是( )A、可用NaOH溶液除去苯中混有的苯酚 B、将乙醇与Al2O3共热可产生使Br2的四氯化碳溶液褪色的气体 C、向淀粉的水解液中加入碘水,溶液变蓝,说明淀粉未水解 D、氨基酸以两性离子的形态存在时,水中溶解度最小,可以形成晶体析出15. 2020年3月24日,中国工程院院士、天津中医药大学校长张伯礼表示,中成药连花清瘟胶囊对于治疗轻型和普通型的新冠肺炎有确切的疗效。其有效成分绿原酸的结构简式如图,下列有关绿原酸说法正确的是( ) A、最多有7个碳原子共面 B、1mol绿原酸可消耗7mol NaOH C、不能与NaHCO3反应产生CO2 D、能发生加成、取代、加聚、缩聚反应16. X、Y、Z、M、Q五种短周期主族元素,原子序数依次增大。元素X、Y、Q的单质在常温下呈气态,元素Y的最高正价和最低负价之和为2,元素Z在同周期的主族元素中原子半径最大,元素M是地壳中含最多的金属元素。下列说法错误的是( )A、元素X、Y可以形成YX3、Y2X4等化合物 B、简单离子半径:Y<Z C、元素Z、M的最高价氧化物对应的水化物能相互反应 D、M、Q两种元素形成的化合物的水溶液呈酸性17. 下列说法正确的是( )A、常温下pH=2的HA溶液与pH=12的BOH等体积混合,溶液pH>7,则BOH为强碱 B、pH=1的盐酸和pH=12的MOH溶液等体积混合后,恰好完全反应,所用盐酸的浓度等于MOH溶液的浓度 C、升高温度,0.1 mol/L的氢氧化钠溶液pH减小,碱性减弱 D、相同温度下,pH相等的氨水和NaOH溶液, 相等18. 医用口罩的外层喷有丙烯的聚合物聚丙烯。某科研机构在酸性条件下,用石墨棒作电极,将CO2转化为丙烯(CH2 =CH—CH3) ,原理如图所示。下列有关叙述错误的是( )
A、最多有7个碳原子共面 B、1mol绿原酸可消耗7mol NaOH C、不能与NaHCO3反应产生CO2 D、能发生加成、取代、加聚、缩聚反应16. X、Y、Z、M、Q五种短周期主族元素,原子序数依次增大。元素X、Y、Q的单质在常温下呈气态,元素Y的最高正价和最低负价之和为2,元素Z在同周期的主族元素中原子半径最大,元素M是地壳中含最多的金属元素。下列说法错误的是( )A、元素X、Y可以形成YX3、Y2X4等化合物 B、简单离子半径:Y<Z C、元素Z、M的最高价氧化物对应的水化物能相互反应 D、M、Q两种元素形成的化合物的水溶液呈酸性17. 下列说法正确的是( )A、常温下pH=2的HA溶液与pH=12的BOH等体积混合,溶液pH>7,则BOH为强碱 B、pH=1的盐酸和pH=12的MOH溶液等体积混合后,恰好完全反应,所用盐酸的浓度等于MOH溶液的浓度 C、升高温度,0.1 mol/L的氢氧化钠溶液pH减小,碱性减弱 D、相同温度下,pH相等的氨水和NaOH溶液, 相等18. 医用口罩的外层喷有丙烯的聚合物聚丙烯。某科研机构在酸性条件下,用石墨棒作电极,将CO2转化为丙烯(CH2 =CH—CH3) ,原理如图所示。下列有关叙述错误的是( )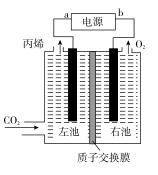 A、a 为电源负极 B、左池的电极反应式:3CO2 +18e- + 18H+=CH2=CH — CH3+6H2O C、H+从右侧通过质子交换膜进入左侧 D、若制取过程中转移 3 mol 电子,则产生 11. 2 L 丙烯19. 下列说法正确的是( )A、恒温恒容下,反应 ,当混合气体的密度不再发生变化时,能表明该反应达到平衡状态 B、对于反应 ,缩小反应容器体积,达到平衡时,c(B)的浓度增大 C、反应 。达至平衡后,升温,则反应速率v(H2)和H2的平衡转化率均增大 D、实验室制氢气,为了加快反应速率,可有稀硫酸中加少量Cu(NO3)2固体20. 已知NA为阿伏加德罗常数的值。下列说法正确的是( )A、1molNH4F晶体中含有共价键数目为4NA B、1L0.1mol/L磷酸钠溶液含有的 数目与0.1L1mol/L磷酸钠溶液含有的 数目相等 C、标况下,3.36LHF中含有的质子数为1.5NA D、60gSiO2晶体中含有的Si-O键数目为2NA21. 一定条件下,分别在甲、乙、丙三个恒容密闭容器中加入A和B,发生反应:3A(g)+B(g)⇌2C(g) ∆H>0,448 K时该反应的化学平衡常数K=1,反应体系中各物质的物质的量浓度的相关数据如下:
A、a 为电源负极 B、左池的电极反应式:3CO2 +18e- + 18H+=CH2=CH — CH3+6H2O C、H+从右侧通过质子交换膜进入左侧 D、若制取过程中转移 3 mol 电子,则产生 11. 2 L 丙烯19. 下列说法正确的是( )A、恒温恒容下,反应 ,当混合气体的密度不再发生变化时,能表明该反应达到平衡状态 B、对于反应 ,缩小反应容器体积,达到平衡时,c(B)的浓度增大 C、反应 。达至平衡后,升温,则反应速率v(H2)和H2的平衡转化率均增大 D、实验室制氢气,为了加快反应速率,可有稀硫酸中加少量Cu(NO3)2固体20. 已知NA为阿伏加德罗常数的值。下列说法正确的是( )A、1molNH4F晶体中含有共价键数目为4NA B、1L0.1mol/L磷酸钠溶液含有的 数目与0.1L1mol/L磷酸钠溶液含有的 数目相等 C、标况下,3.36LHF中含有的质子数为1.5NA D、60gSiO2晶体中含有的Si-O键数目为2NA21. 一定条件下,分别在甲、乙、丙三个恒容密闭容器中加入A和B,发生反应:3A(g)+B(g)⇌2C(g) ∆H>0,448 K时该反应的化学平衡常数K=1,反应体系中各物质的物质的量浓度的相关数据如下:容器
温度/K
起始时物质的浓度/(mol·L−1)
10分钟时物质的浓度/(mol·L−1)
c(A)
c(B)
c(C)
甲
448
3
1
0.5
乙
T1
3
1
0.4
丙
448
3
2
a
下列说法错误的是( )
A、甲中,10分钟内A的化学反应速率:υ(A)=0.075 mol·L−1·min−1 B、甲中,10分钟时反应已达到化学平衡状态 C、乙中,T1<448 K、K乙<K甲 D、丙中,达到化学平衡状态时A的转化率大于25%22. 如图为某反应分别在有和没有催化剂条件下的能量变化示意图,下列说法错误的是( ) A、反应过程 b 有催化剂参与 B、该反应为放热反应,热效应等于 ΔH C、有催化剂条件下,反应的活化能等于 E1+E2 D、反应过程 a 需要外界供给能量才能持续进行23. 常温下,用0.10 mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1CH3COOH溶液和HCN溶液,所得滴定曲线如图。下列说法错误的是( )
A、反应过程 b 有催化剂参与 B、该反应为放热反应,热效应等于 ΔH C、有催化剂条件下,反应的活化能等于 E1+E2 D、反应过程 a 需要外界供给能量才能持续进行23. 常温下,用0.10 mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1CH3COOH溶液和HCN溶液,所得滴定曲线如图。下列说法错误的是( ) A、点①所示溶液中,CN-的水解程度大于HCN的电离程度 B、点①和点②所示溶液中:c(CN-)>c(CH3COO-) C、点③所示溶液中:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) D、点④所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)24. 过碳酸钠(2Na2CO3·3H2O2)是一种白色晶体,具有无毒,无臭,无污染等优点,常做食品、医药、卫生等部门的去污剂、清洗剂、杀毒剂,也是一种性能优异的急救供氧剂。可用碳酸钠和双氧水化合制备: ,下列说法错误的是( )A、过碳酸钠具有强氧化性 B、1mol过碳酸钠发生热分解,转移的电子数为3NA C、生产过种中若遇到酸、铁盐等都可能导致产率下降 D、将过碳酸钠溶液与亚硫酸氢钠溶液混合,发生的反应为2Na2CO3·3H2O2+3NaHSO3=2Na2CO3+3NaHSO4+3H2O25. 下列方案设计、现象和结论都正确的是( )
A、点①所示溶液中,CN-的水解程度大于HCN的电离程度 B、点①和点②所示溶液中:c(CN-)>c(CH3COO-) C、点③所示溶液中:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) D、点④所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)24. 过碳酸钠(2Na2CO3·3H2O2)是一种白色晶体,具有无毒,无臭,无污染等优点,常做食品、医药、卫生等部门的去污剂、清洗剂、杀毒剂,也是一种性能优异的急救供氧剂。可用碳酸钠和双氧水化合制备: ,下列说法错误的是( )A、过碳酸钠具有强氧化性 B、1mol过碳酸钠发生热分解,转移的电子数为3NA C、生产过种中若遇到酸、铁盐等都可能导致产率下降 D、将过碳酸钠溶液与亚硫酸氢钠溶液混合,发生的反应为2Na2CO3·3H2O2+3NaHSO3=2Na2CO3+3NaHSO4+3H2O25. 下列方案设计、现象和结论都正确的是( )选项
目的
方案设计
现象和结论
A
探究Cu(OH)2和Mg(OH)2溶解度大小
向氢氧化钠溶液中先加入少量MgCl2溶液,充分反应后再加入少量CuSO4溶液
先产生白色沉淀,后产生蓝色沉淀,则证明Cu(OH)2比Mg(OH)2难溶
B
检验铁与水蒸气反应中有三价铁
取少量铁与水蒸气反应后的固体,先加入稀盐酸再加KSCN溶液
若溶液变血红色,则有三价铁,若不变血红色则无三价铁
C
检验牙膏中是否有甘油
取少量该牙膏于试管中,加入适量蒸馏水,搅拌静置后,取上层清液,加入适量新制Cu(OH)2 , 观察现象
若产生绛蓝色沉淀,则该牙膏中含有甘油
D
检验火柴头中的氯元素
摘下几根火柴头,将火柴头浸于水中,片刻后取少量溶液于试管中,加硝酸酸化的AgNO3和NaNO2
若观察到白色沉淀,则含氯元素
A、A B、B C、C D、D二、综合题
-
26.(1)、常温下,乙醇在(填“环己烷或乙酸”)中溶解度更大,主要原因是。(2)、Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是。
化合物
TiF4
TiCl4
TiBr4
TiI4
熔点/℃
377
-24.12
38.3
155
27. 用双氧水氧化法可处理电镀废水中的氰化物(CN-)和有机添加剂。一定pH下H2O2可使CN-转化为无害的 和N2。现向某废水中加入用量为1.02 mL/L的30%H2O2(密度为1.11 g/mL),处理前后CN-的质量浓度如下表所示,已知该废水中的有机添加剂的耗H2O2量为CN-的3倍。此外过量的H2O2需加入焦亚硫酸钠(Na2S2O5)还原除去。请计算需加入焦亚硫酸钠(Na2S2O5)的量为g/L,(不考虑H2O2的自身分解和溶液体积的变化)写出计算过程。质量浓度(mg/L)
处理前
处理后
CN-
5.41
0.21
28.(1)、I.离子化合物A由三种常见的短周期元素组成,其中两种是金属元素,一种是非金属元素。按以下流程进行实验:
请回答:
组成A的元素为。(填元素符号)
(2)、写出固体C部分溶于NaOH溶液的离子反应方程式。(3)、A与盐酸发生氧化还原反应,且有无色无味的气体生成,写出该化学反应方程式。(4)、II.某兴趣小组为了探究84消毒液(主要成分NaClO)和酒精混合使用是否存在安全隐患,利用如图装置进行实验。
请回答:
A中出现黄绿色气体,请写出相应的化学方程式。(乙醇氧化为乙醛)
(5)、有同学用手触碰三颈烧瓶后发现,反应一段时间后装置温度升高,所以提出产生的气体中可能混有O2 , 该同学为了验证O2 , 打开弹簧夹,用带火星的木条检验,该操作的不正确原因为。29. 亚氯酸钠(NaClO2)是一种高效含氯消毒剂和漂白剂,主要用于自来水、污水等水环境的杀菌消毒,也常用作纸浆、砂糖、油脂的漂白剂。图为目前生产亚氯酸钠的流程之一(夹持装置省略),所得NaClO2具有纯度高的优点。
已知:NaClO2饱和溶液在低于38℃时会析出NaClO•3H2O,高于38℃时析出NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl。
试回答下列问题:
(1)、仪器a的名称为。(2)、装置A用来制取ClO2 , 发生反应的离子方程式为。(3)、研究测得C装置吸收液中的c(NaOH)与 对粗产品中NaClO2含量的影响如图所示。则最佳条件为c(NaOH)=mol/L, =。 (4)、C装置采用“冰水浴”的目的是。(5)、充分反应后,为从产品溶液中获取NaClO2晶体,从下列选项中选出合理的操作并排序:( )→( )→( )→干燥,
(4)、C装置采用“冰水浴”的目的是。(5)、充分反应后,为从产品溶液中获取NaClO2晶体,从下列选项中选出合理的操作并排序:( )→( )→( )→干燥,a.趁热过滤 b.50℃水洗涤 c.加热蒸发结晶 d.冰水洗涤 e.55℃恒温减压蒸发结晶
(6)、在化学定分析中为了方便计算,常用滴定度(T)表示标准液的滴定能力,是指每毫升标准溶液相当于样品中所含被测物质的质量。准确称取一定质量的NaClO2(摩尔质量为Mg/mol)样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应: ,得待测溶液。取一定量消耗待测溶液,以淀粉溶液作指示剂,消耗 标准液V mL(已知: )。则滴定度T=g/mL。30. 研究大气污染物和水污染物的处理对建设美丽中国具有重要意义。汽车尾气中的CO、 、碳氮化合物是大气污染物。科研工作者经过研究,可以用不同方法处理氮的氧化物﹐防止空气污染。回答下列问题:(1)、已知:能将NO转化成无毒物质。写出在298K时该反应的热化学方程式:。
(2)、我国科研人员研究出了用活性炭对汽车尾气中NO处理的方法: 。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,反应相同时间时,测得NO的转化率 (NO)随温度的变化关系如图所示:
由图可知,温度低于1050K时,NO的转化率随温度升高而增大,原因是。用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作 )。在1050K、 时,该反应的化学平衡常数 [已知:气体分压 气体总压 体积分数]。
(3)、氮氧化物也可以用尿素 水溶液吸收。用尿素水溶液吸收体积比为1∶1的NO和 混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为。(4)、科研人员进一步对比研究了活性炭负载钙、铜氧化物的反应活性。在三个反应器中分别加入C、CaO/C、 /C,通入NO使其浓度达到0.1 。不同温度下,测得2小时时NO去除率如图所示:
①据图分析,490 以下反应活化能最小的是(用a、b、c表示);CaO/C、 /C去除NO效果比C更好,其理由是。(写出一条即可)
②上述实验中,490 时,若测得CaO/C对NO的去除率为60%,则可能采取的措施是。
A.恒容下,及时分离出 B.压缩体积 C.恒容下,向体系通入氮气
③490 时的反应速率 ,该温度下此反应的平衡常数为121,则反应达到平衡时NO的去除率为(保留两位有效数字)。
31. 盐酸利多卡因是一种常见的局部麻醉药,其合成路线如图:
已知:

回答下面的问题:
(1)、下列说法正确的是___________A、化合物A的名称为对二甲苯 B、化合物C分子中有4种化学环境不同的H原子 C、化合物F具有碱性 D、盐酸利多卡因的化学式为(2)、化合物E的结构简式为 , 的另一无机产物为。(3)、 的化学方程式为。(4)、写出3种符合要求的B的同分异构体:①含有苯环,能发生水解反应 ② 显示分子中含有4种化学环境不同的H原子 ③分子中不存在 键
(5)、利用题给反应可以合成许多有机物,请以 和乙烯为原料,合成 ,其他无机试剂任选。
,其他无机试剂任选。