四川省南充市2021年高考化学三模试卷
试卷更新日期:2021-06-10 类型:高考模拟
一、单选题
-
1. 化学与生产、生活密切相关。下列说法正确的是( )A、为阻止新型冠状病毒传播,可利用84消毒液对环境进行消毒 B、维生素C具有较强的氧化性,常用作氧化剂 C、中国传统制油条的口诀是“一碱、二矾、三钱盐”,其中“碱”是火碱 D、我国自主研发的5G芯片材料是二氧化硅2. 室温下H2SO4是二元强酸,其稀溶液中,第一步解离是完全的,第二步解离程度较低,HSO H++SO (K2=1.0×10-2)。设NA为阿伏加德罗常数的值,下列说法正确的是( )A、56 g单质铁与足量稀硫酸反应产生22.4 L H2 B、1 L 0.1 mol/L的硫酸溶液中,含H+的数目为0.2 NA C、室温下,NaHSO4溶液显碱性 D、稀硫酸溶液中存在关系:c(HSO )+c(OH-)+2c(SO )=c(H+)3. 绿原酸具有很高的药用价值,其结构如图所示,下列说法正确的是( )
 A、该物质不能使酸性高锰酸钾溶液褪色 B、其苯环上的一氯代物有三种 C、1 mol绿原酸与5 mol H2发生加成反应 D、分子中所有C原子可能共面4. W、X、Y、Z为原子序数依次增大,且分属于三个不同周期的短周期元素,X、Y同周期。X、Y、Z可形成一种无色剧毒气体(结构如图所示),下列说法错误的是( )
A、该物质不能使酸性高锰酸钾溶液褪色 B、其苯环上的一氯代物有三种 C、1 mol绿原酸与5 mol H2发生加成反应 D、分子中所有C原子可能共面4. W、X、Y、Z为原子序数依次增大,且分属于三个不同周期的短周期元素,X、Y同周期。X、Y、Z可形成一种无色剧毒气体(结构如图所示),下列说法错误的是( ) A、X、Y、Z形成的简单氢化物中Y的氢化物熔沸点最高 B、Z元素形成的含氧酸均为强酸 C、W与X、Y均能形成至少2种二元化合物 D、原子半径X大于Y5. 下列实验分离操作能达到目的的是( )
A、X、Y、Z形成的简单氢化物中Y的氢化物熔沸点最高 B、Z元素形成的含氧酸均为强酸 C、W与X、Y均能形成至少2种二元化合物 D、原子半径X大于Y5. 下列实验分离操作能达到目的的是( ) A、甲:分离碘单质和氯化铵的混合固体 B、乙:分离硫酸钡固体和氯化钠溶液的混合物 C、丙:分离乙醇和水的混合溶液 D、丁:分离硝基苯和苯的混合溶液6. 化学反应原理是研究化学的重要工具,下列相关说法正确的是( )A、CH4(g)+Cl2(g) CH3Cl(g)+HCl(g)能自发进行,则该反应 H>0 B、向碳酸钠溶液中通入少量的氯气:Na2CO3+H2O+2Cl2=2HClO+2NaCl+CO2 C、室温下,稀释0.1 mol/L的HClO溶液,溶液中c(ClO-)减小 D、向硫酸钡悬浊液中加入足量饱和碳酸钠溶液,振荡过滤洗涤,向沉淀中加入盐酸溶液有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3)7. 科学家最近设计出了质子膜H2S电池,实现了H2S废气变废为宝,电池结构原理如图,下列相关说法正确的是( )
A、甲:分离碘单质和氯化铵的混合固体 B、乙:分离硫酸钡固体和氯化钠溶液的混合物 C、丙:分离乙醇和水的混合溶液 D、丁:分离硝基苯和苯的混合溶液6. 化学反应原理是研究化学的重要工具,下列相关说法正确的是( )A、CH4(g)+Cl2(g) CH3Cl(g)+HCl(g)能自发进行,则该反应 H>0 B、向碳酸钠溶液中通入少量的氯气:Na2CO3+H2O+2Cl2=2HClO+2NaCl+CO2 C、室温下,稀释0.1 mol/L的HClO溶液,溶液中c(ClO-)减小 D、向硫酸钡悬浊液中加入足量饱和碳酸钠溶液,振荡过滤洗涤,向沉淀中加入盐酸溶液有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3)7. 科学家最近设计出了质子膜H2S电池,实现了H2S废气变废为宝,电池结构原理如图,下列相关说法正确的是( ) A、电极a为正极,发生还原反应 B、H+经过固体电解质膜向a电极移动 C、电极b的反应为:O2+4e-+4H+=2H2O D、用该电池进行粗铜的精炼,当电路中转移2 mol e-时,阳极减轻64g
A、电极a为正极,发生还原反应 B、H+经过固体电解质膜向a电极移动 C、电极b的反应为:O2+4e-+4H+=2H2O D、用该电池进行粗铜的精炼,当电路中转移2 mol e-时,阳极减轻64g二、综合题
-
8. 苯胺是一种重要精细化工原料,在染料、医药等行业中具有广泛的应用。实验室以苯为原料制取苯胺,其原理简示如下:
 +HNO3
+HNO3  +H2O
+H2O +3H2
+3H2  +2H2O
+2H2O物质
沸点/℃
密度/(g*cm3)
部分性质
苯
80
0.88
无色油状液体,难溶于水
硝基苯
210.9
1.23
无色或淡黄色油状液体,不溶于水,易溶于乙醇、乙醚
苯胺
184.4.
1.02
无色油状液体,微溶于水,易溶于乙醇、乙醚:还原性强,易被氧化
实验步骤:
(1)、I.制取硝基苯实验室采用如图所示装置制取硝基苯,A中装有一定量的苯,三颈烧瓶装有一定比例的浓硫酸和浓硝酸混合物。请回答下列问题:

仪器A的名称是。
(2)、配制浓硫酸和浓硝酸的混合物时,应将逐滴加入到中,并及时搅拌和冷却。(3)、实验装置中长玻璃导管的作用是。(4)、粗硝基苯用5% NaOH溶液洗涤的目的是。(5)、II.制取苯胺①组装好实验装置(如图,夹持仪器已略去),并检查气密性。②先向三颈烧瓶中加入沸石及硝基苯,再取下恒压分液漏斗,换上温度计。③打开活塞K,通入H2一段时间。④利用油浴加热,使反应液温度维持在140℃进行反应。⑤反应结束后,关闭活塞K,向三颈烧瓶中加入生石灰。⑥调整好温度计的位置,继续加热,收集182~186℃馏分,得到较纯苯胺。

回答下列问题:
操作①中加入沸石的作用 , 冷凝装置中的冷凝水应该从(填“a”或者“b”)口进入。
(6)、若实验中步骤③和④的顺序颠倒,则实验中可能产生的不良后果是。(7)、蒸馏前,步骤⑤中加入生石灰的作用是。(8)、若实验中硝基苯用量为5 mL,最后得到苯胺2.79 g,苯胺的产率为。9. 甲烷水汽重整反应(SMR)是我国主要的制氢技术,可以转变我国能源结构,助力我国实现“碳达峰”的目标。SMR反应常伴随水煤气变换反应(WGS):SMR:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=a kJ·mol-1 K1=1.198×
WGS:CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=b kJ·mol-1 K2=1.767×
回答下列问题:
(1)、根据SMR和WGS的平衡常数,判断:ΔH10,ΔH20(填“<”或“>”)。(2)、CO2甲烷化也是实现“碳达峰”的重要途径,反应机理如图,写出该反应的化学反应方程式 , 该反应的ΔH= , 关于这一反应机理,下列说法正确的是。
A.CO2被吸附在MgO的表面而发生反应 B.Pd是反应的催化剂
C.反应过程既有碳氧键的断裂,也有碳氧键的形成 D.反应过程中有CO分子中间体生成
(3)、一定条件下,向恒容平衡反应器中通入1 MPa CH4和3 MPa H2O(g),发生SMR和WGS反应,平衡时,CO为m MPa,H2为n MPa,此时CH4(g)的分压为MPa(用含m、n的代数式表示)。(4)、SMR中,CH4分子与H2O分子在催化剂Ni表面的活性位点(能够发生断键的表面区域)断键并发生反应,实验测得甲烷的反应速率 。随水蒸气分压 的变化如下图1, 超过25 kPa时, 随 的增大而减小,原因是。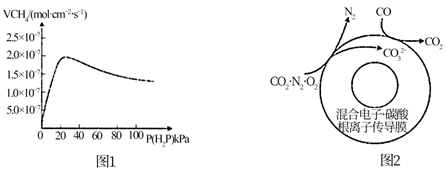 (5)、SMR和WGS工艺会产生CO2废气,可以基于原电池原理,利用混合电子-碳酸根离子传导膜捕获废气(N2、CO2、O2)中的CO2 , 如上图2,CO2在电池极(填“正”或“负”)被捕获,该电极反应方程式为。10. 以菱锰矿(主要成分为MnCO3 , 还含有Fe3O4、FeO、MgCO3等杂质)为原料制备MnSO4的工艺流程如下图:
(5)、SMR和WGS工艺会产生CO2废气,可以基于原电池原理,利用混合电子-碳酸根离子传导膜捕获废气(N2、CO2、O2)中的CO2 , 如上图2,CO2在电池极(填“正”或“负”)被捕获,该电极反应方程式为。10. 以菱锰矿(主要成分为MnCO3 , 还含有Fe3O4、FeO、MgCO3等杂质)为原料制备MnSO4的工艺流程如下图:
已知:常温下,Ksp(MnS)=1×10-11.金属离子生成氢氧化物沉淀的pH如下表:
金属离子
Fe3+
Fe2+
Mn2+
Mg2+
开始沉淀
1.5
6.3
7.6
9.6
完全沉淀
2.8
8.3
10.2
11.6.
(1)、酸浸时选择H2SO4而不是HCl的原因可能是和 , 沉淀池1中,加入MnO2时发生反应的离子方程式为。(2)、该工艺流程中废渣和沉淀1、2均需用水洗涤,并将洗涤液返回酸浸工序,目的是。(3)、沉淀2的化学式是 , 不能用NaOH代替NaF,其原因是。(4)、含MnSO4溶液中还含有杂质(填离子符号),利用KMnO4溶液与Mn2+反应生成黑色沉淀的现象可以检验Mn2+ , 发生反应的离子方程式为。(5)、电解MnSO4溶液可进一步获得二氧化锰,电解后的废水中还含有Mn2+ , 常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1 , 则应保持溶液中c(S2-)≥mol·L-1。11. 电石(CaC2)是一种用于生产乙炔的浅色固体。它是由氧化钙与焦炭反应形成的:CaO+3C CaC2+CO。德国化学家维勒发现,电石与水反应释放出乙炔气体(C2H2)和氢氧化钙,也含有H2S、PH3等杂质气体。回答下列问题:
(1)、上述六种元素中,电负性最大的是(填写元素名称),原子半径最大者在基态时核外电子占据的轨道数目为个。(2)、H2S、PH3分子中心原子的价层电子对数目(填“相同”或“不同”)。根据等电子原理,画出C 离子的电子式 , 乙炔分子中C原子的杂化方式为。(3)、已知键能数据如下表:化学键
N-N
N= N
N=N
键能/kJ.mol-1
247
418
942
化学键
C-O
C=O
C=O
键能/kJ. mol-1
351
745
1072
请解释CO比N2容易发生反应:。
(4)、如图为电石的四方晶胞(长方体),钙离子位于 , 它填入C 离子围成的八面体空隙。计算一个晶胞内含有化学式的数量为。 (5)、已知电石密度为2.13 g·cm-3 , 阿伏加德罗常数为6.02×1023 mol-1 , x、y值均为a (1 =10-10m),则z=nm(用含a的式子表示,且数字保留整数)。已知a<4.0,则距离钙最近的C 中心有个。12. 科学家们特别关注两种吸收紫外线的化学物质X和Y。其合成路线分别如下:
(5)、已知电石密度为2.13 g·cm-3 , 阿伏加德罗常数为6.02×1023 mol-1 , x、y值均为a (1 =10-10m),则z=nm(用含a的式子表示,且数字保留整数)。已知a<4.0,则距离钙最近的C 中心有个。12. 科学家们特别关注两种吸收紫外线的化学物质X和Y。其合成路线分别如下:
已知:
 +H2O
+H2O
回答下列问题:
(1)、A为单一官能团化合物,其中含氧官能团名称为。C具有两个相同官能团,C的化学名称为。X的分子式为。(2)、鉴别A和D可以选用的试剂为(填序号)。①NaOH溶液 ②FeCl3溶液 ③NaHCO3溶液
(3)、醛E的核磁共振氢谱显示吸收峰面积为3:2:2:1,写出E的结构简式为。F生成饱和一元醇G的反应类型为 , G中含有个手性碳(注:连接四个各不相同的基团和原子的碳)。(4)、写出饱和一元醇G与乙酸生成H的化学方程式。(5)、Y吸收紫外线后形成双聚体 等多种异构体,请指出这样的双聚体共有种(不考虑手性异构)。
等多种异构体,请指出这样的双聚体共有种(不考虑手性异构)。