四川省成都市2021年高考化学三模试卷
试卷更新日期:2021-06-10 类型:高考模拟
一、单选题
-
1. 碳元素的相关研究获诺贝尔奖最多。其中焦炭主要含石墨微晶,煤干馏技术提升能改变焦炭的孔隙大小,满足下游产品丰富的应用要求。下列相关说法正确的是( )A、焦炭与金刚石一样是碳的同素异形体,化学性质相同 B、煤干馏的温度不同得到的产物及应用不同 C、空隙多的焦炭具有更好的消毒杀菌性能 D、炼铁时焦炭作还原剂高炉尾气中只含CO22. 苯乙酸苄酯(
 )是花香型香料,下列对苯乙酸苄酯的相关分析正确的是( ) A、分子中所有碳原子可能共平面 B、可在不同条件下水解,产物均为
)是花香型香料,下列对苯乙酸苄酯的相关分析正确的是( ) A、分子中所有碳原子可能共平面 B、可在不同条件下水解,产物均为 和
和  C、其苯环上的一溴代物最多有3种
D、苯乙酸苄酯易溶于水及乙醇
3. 下列方程式能正确解释相应实验的是( )A、用惰性电极电解饱和AlCl3溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- B、实验室制备Fe(OH)3胶体:FeCl3+3NaOH=Fe(OH)3(胶体)+3NaCl C、将水垢浸泡在饱和碳酸钠溶液中:CO +Ca2+=CaCO3↓ D、将浓氨水滴在氢氧化钠固体上:NH3·H2O NH3↑+H2O4. X、Y、Z、W四种短周期元素位于三个不同的周期,且原子序数依次增大。它们能形成结构如图所示的分子,下列推断错误的是( )
C、其苯环上的一溴代物最多有3种
D、苯乙酸苄酯易溶于水及乙醇
3. 下列方程式能正确解释相应实验的是( )A、用惰性电极电解饱和AlCl3溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- B、实验室制备Fe(OH)3胶体:FeCl3+3NaOH=Fe(OH)3(胶体)+3NaCl C、将水垢浸泡在饱和碳酸钠溶液中:CO +Ca2+=CaCO3↓ D、将浓氨水滴在氢氧化钠固体上:NH3·H2O NH3↑+H2O4. X、Y、Z、W四种短周期元素位于三个不同的周期,且原子序数依次增大。它们能形成结构如图所示的分子,下列推断错误的是( ) A、X、Z原子之间形成的是极性共价键 B、气态氢化物的沸点:W>Z C、右图分子中Y满足最外层8电子稳定结构 D、最高价含氧酸的酸性:W>Y5. 将铁棒插入95%的浓硫酸中(如图所示),探究铁与浓硫酸的反应。观察到立即产生大量的细腻气泡聚集在液体表面,犹如白色泡沫,由快变慢直至停止,酸液中出现白色不溶物,静置后分层。下列说法错误的是( )
A、X、Z原子之间形成的是极性共价键 B、气态氢化物的沸点:W>Z C、右图分子中Y满足最外层8电子稳定结构 D、最高价含氧酸的酸性:W>Y5. 将铁棒插入95%的浓硫酸中(如图所示),探究铁与浓硫酸的反应。观察到立即产生大量的细腻气泡聚集在液体表面,犹如白色泡沫,由快变慢直至停止,酸液中出现白色不溶物,静置后分层。下列说法错误的是( ) A、产生的气体可能是SO2和少量的H2 B、取上层清液滴加少量饱和FeSO4溶液,有白色固体X析出,推测固体X可能是FeSO4 C、反应过程中FeSO4的生成也可能使反应由快变慢 D、取反应后铁棒直接放入盛有KSCN溶液的烧杯中,可检验反应时是否有Fe3+生成6. 锂空气电池因其比能量非常高,具有广阔应用前景。下图是两种不同的锂空气(Li-O2)电池,下列分析错误的是( )
A、产生的气体可能是SO2和少量的H2 B、取上层清液滴加少量饱和FeSO4溶液,有白色固体X析出,推测固体X可能是FeSO4 C、反应过程中FeSO4的生成也可能使反应由快变慢 D、取反应后铁棒直接放入盛有KSCN溶液的烧杯中,可检验反应时是否有Fe3+生成6. 锂空气电池因其比能量非常高,具有广阔应用前景。下图是两种不同的锂空气(Li-O2)电池,下列分析错误的是( ) A、放电时图1中电流从a电极经电解液流回b电极 B、放电时,两种电池负极反应式均为:Li-e-=Li+ C、转移相同电子,两种电池正极产物的物质的量相同 D、两种不同的锂空气电池比能量不同7. 常温下,向Na2SO3溶液中缓慢通入氯化氢气体,溶液中pH与离子浓度的变化关系如图所示。(“pc”指浓度的负对数,如pc(HR)=-lgc(HR))下列说法中正确的是( )
A、放电时图1中电流从a电极经电解液流回b电极 B、放电时,两种电池负极反应式均为:Li-e-=Li+ C、转移相同电子,两种电池正极产物的物质的量相同 D、两种不同的锂空气电池比能量不同7. 常温下,向Na2SO3溶液中缓慢通入氯化氢气体,溶液中pH与离子浓度的变化关系如图所示。(“pc”指浓度的负对数,如pc(HR)=-lgc(HR))下列说法中正确的是( ) A、L2表示pH与 之间的关系 B、由图可知,Ka2(H2SO3)=10-1.8 C、M点溶液中:c(Na+)=2c(HSO )+3c(H2SO3) D、pH=5溶液中:c(HSO )>c(SO )>c(H2SO3)
A、L2表示pH与 之间的关系 B、由图可知,Ka2(H2SO3)=10-1.8 C、M点溶液中:c(Na+)=2c(HSO )+3c(H2SO3) D、pH=5溶液中:c(HSO )>c(SO )>c(H2SO3)二、综合题
-
8. KMnO4是一种常见强氧化剂,从软锰矿制备KMnO4有以下步骤。回答下列问题:(1)、I.熔融制K2MnO4
将MnO2固体与KOH固体混合加热熔融得到K2MnO4 , 化学方程式是。
(2)、该步骤需要在(填仪器名称)中熔融,同时还需要用到的仪器是(填序号)。A.
 B.
B.  C.
C.  D.
D.  E.
E.  (3)、II.Cl2氧化制备KMnO4
(3)、II.Cl2氧化制备KMnO4已知:K2MnO4在酸性或者中性的水溶液中易歧化

A中使用油浴加热的优点是。
(4)、连接装置:顺序为a→→→→→→ (按气流方向,用小写字母表示);操作为:连接装置, , 打开流速控制器。(5)、该实验需严格控制A中浓盐酸流速,若过快,产生的不利后果是。9. 镍氢电池有着广泛的应用,旧电池的回收和再利用同样的重要。废旧镍氢电池中常含有NiOOH、Ni(OH)2、及少量Co(OH)2、FeO等,以下为金属分离以及镍的回收流程,按要求回答下列问题: (1)、N2H4的电子式是;“酸浸”中,加入N2H4的主要作用是。(2)、“氧化”过程中与Fe2+有关的离子方程式是 , 滤渣1主要成分是弱碱,其化学式是。(3)、已知 =8.0×10-44 , 当三价钴沉淀完全时,溶液pH=。(已知:lg2=0.3)(4)、滤液A的主要溶质是;操作X是(5)、用滴定法测定NiCO3产品中镍元素含量。取2.500g样品,酸溶后配成250mL溶液,取20.00mL于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为0.1000mol/L的Na2H2Y溶液进行滴定。
(1)、N2H4的电子式是;“酸浸”中,加入N2H4的主要作用是。(2)、“氧化”过程中与Fe2+有关的离子方程式是 , 滤渣1主要成分是弱碱,其化学式是。(3)、已知 =8.0×10-44 , 当三价钴沉淀完全时,溶液pH=。(已知:lg2=0.3)(4)、滤液A的主要溶质是;操作X是(5)、用滴定法测定NiCO3产品中镍元素含量。取2.500g样品,酸溶后配成250mL溶液,取20.00mL于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为0.1000mol/L的Na2H2Y溶液进行滴定。已知:①Ni2++H2Y2-=[NiY]2-+2H+
②紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
①滴定终点的现象是。
②如果紫脲酸胺滴入过多,终点延迟,则会导致。
10. 甲烷-CO2重整反应可以得到用途广泛的合成气,已知方程式如下。回答下列问题:CH4(g)+CO2(g)=2H2(g)+2CO(g) ΔH>0
(1)、相关物质的燃烧热数据如下表所示:物质
CH4(g)
CO(g)
H2(g)
燃烧热(kJ·mol-1)
890.3
283.0
285.8
① ΔH=kJ·mol-1
② 用Ni基双金属催化,反应的活化能降低,ΔH(填“变大”、“变小”或者“不变”)
(2)、控制其它条件不变,改变温度对合成气中甲烷质量分数的影响如图。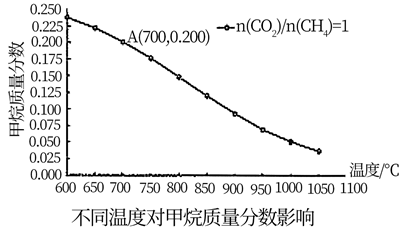
若充入a molCH4 , 经过2小时后达到如右图A点,2小时内用CH4表示的平均反应速率为mol/h(用a表示);假设A为平衡态,此时压强为2MPa,平衡常数Kp=(用平衡分压代替平衡浓度,分压=总压x物质的量分数,保留2位小数)。
(3)、甲烷的重整反应速率可以表示为η=k·p(CH4) [p(CH4)是指甲烷的分压],其中k为速率常数。下列说法正确的是。a.增加甲烷的浓度,η增大 b.增加CO2浓度,η增大
c.及时分离合成气,η增大 d.通过升高温度,提升k
(4)、已知在高温的条件下,会发生如下副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.0 kJ·mol-1 , 且温度越高副反应的转化率越高,化学上称之为“温度的选择性”。不同n(CO2)/n(CH4)配比随温度变化对平衡时n(H2)/n(CO)配比的影响如图所示。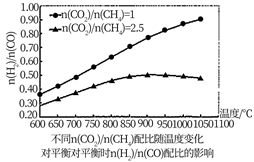
按n(CO2)/n(CH4)=2.5的配比进料,随温度升高,合成气n(H2)/n(CO)配比“先增加后减小”。增加是因为高温有利甲烷分解的积碳反应,请解释“减小”的可能原因。
(5)、一定温度下反应会出现积碳现象而降低催化剂活性。如图是Ni基双金属催化剂抗积碳的示意图。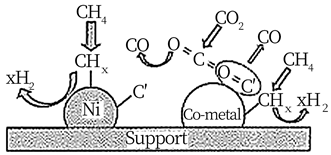
结合图示:
①写出一个可能的积碳反应方程式。
② 金属钴能有效消碳的原因是。
11. 水滑石(LDHs)阻燃剂,是由带正电荷的主体层板和插入层板间的阴离子组装而成。引入Ca2+、Mg2+、Al3+、B(OH) 、SiO 等离子可改变其性能。回答下列问题:(1)、基态Ca原子中,核外电子占据最高能层的符号是 , 占据该能层电子的电子云轮廓图形状为。(2)、元素镁和铝的第一电离能I1(Mg)I1(Al)(填“>”或“<”)。(3)、B(OH) 中B原子的杂化形式为 , 空间立体构型为;“水滑石”层间阴离子通过作用力与层板结合。(4)、原硅酸(H4SiO4)较稳定,为原酸结构 。而类似结构的原碳酸(H4CO4)则不能稳定存在,试从结构角度解释其原因。 (5)、Li、Al、Si三元化合物晶胞结构如下图所示。
。而类似结构的原碳酸(H4CO4)则不能稳定存在,试从结构角度解释其原因。 (5)、Li、Al、Si三元化合物晶胞结构如下图所示。
①该化合物的化学式是。
②已知晶胞参数为5.93A,Si与Al之间的共价键长是(写出计算表达式)。
12. 盐酸阿比朵尔(Arbidl Hydmchloride)是广谱抗病毒药。李兰娟院士团队发现它能有效抑制新型冠状病毒(COVID-19),其合成路线如下: 回答下列问题:(1)、A中含氧官能团的名称是(2)、反应①分为两步进行,完成反应ii
回答下列问题:(1)、A中含氧官能团的名称是(2)、反应①分为两步进行,完成反应ii反应i.
 +NH3
+NH3 
反应ii , 其反应类型是。
(3)、反应②生成1mol的D消耗mol Br2;反应③加入KHCO3的作用是。(填序号)。(4)、G为盐酸盐,其中H+与-N(CH3)2间形成的作用力是___________。A、共价键 B、离子键 C、范德华力 D、氢键(5)、H是A的同分异构体,核磁共振氢谱显示有2种峰,且峰值面积是2:3,写出H的一种可能的结构简式。(6)、根据相关信息并结合已有知识,写出以 、
、  制备扑炎痛
制备扑炎痛  的合成路线(其它试剂任选)。。
的合成路线(其它试剂任选)。。
已知: +
+ 
 +NaCl
+NaCl