陕西省咸阳市2021年高考化学三模试卷
试卷更新日期:2021-06-10 类型:高考模拟
一、单选题
-
1. 我国四川广汉的三星堆遗址距今已有3000~5000年历史,2021年3月20日,三星堆遗址新出土了多达500多件重要文物,如黄金面具、丝绸“黑炭”、青铜神树、陶瓷碎片等。下列有关叙述错误的是( )A、考古时利用 C测定文物的年代, C的中子数为8 B、黄金面具、青铜神树的成分均为纯金属 C、丝绸转化为“黑炭”的过程涉及化学变化 D、三星堆中含有大量的陶瓷碎片,属于无机非金属材料2. 抗麻风药物clofazimine对SARS—CoV—2表现出强大的抗病毒活性,并能缓解与重症COVID—19相关的过度炎症反应。clofazimine的结构简式如图所示:
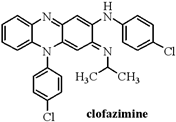
下列有关clofazimin的叙述正确的是( )
A、属于芳香烃,分子式为C27H21Cl2N4 B、能发生取代、氧化、缩聚反应 C、该物质存在含5个苯环的同分异构体 D、1molclofazimine最多能与11molH2发生加成反应3. 冬季燃煤活动排放的大量活性溴化合物BrCl能通过光解释放溴自由基和氯自由基,从而影响大气中自由基(OH、HO2、RO2)的浓度,其原理循环如图所示。下列说法正确的是( ) A、活性溴化合物BrCl中含非极性键 B、溴自由基和氯自由基只具有氧化性 C、通过循环大气中OH自由基的浓度降低 D、BrCl的排放会造成臭氧含量减少、水中汞含量超标等4. MDI广泛应用于聚氨酯弹性体,其结构简式如图,其中W、X、Y、Z原子序数依次增大,且均小于10。
A、活性溴化合物BrCl中含非极性键 B、溴自由基和氯自由基只具有氧化性 C、通过循环大气中OH自由基的浓度降低 D、BrCl的排放会造成臭氧含量减少、水中汞含量超标等4. MDI广泛应用于聚氨酯弹性体,其结构简式如图,其中W、X、Y、Z原子序数依次增大,且均小于10。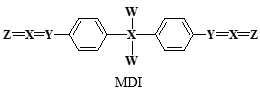
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A、元素非金属性:X>Y>Z B、W、X、Z形成的化合物一定是二元弱酸 C、W与X、Y、Z均可形成至少2种10电子微粒 D、1molMDI中所含X—W键为2NA5. 苯甲酸乙酯为无色液体,相对密度为1.0458,沸点为212℃,微溶于水,易溶于乙醚。实验室常由苯甲酸和乙醇在浓硫酸催化下反应制备,粗产物经洗涤、乙醚萃取、干燥及蒸馏等操作后得到纯品。已知乙醚的相对密度为0.7134,沸点34.5℃。下列说法错误的是( ) A、该反应为可逆反应,及时将生成的水移除反应体系可提高产率 B、用乙醚萃取苯甲酸乙酯时,有机相位于分液漏斗的下层 C、冷水和Na2CO3溶液洗涤的目的是除去浓硫酸和未反应的苯甲酸 D、蒸馏除去乙醚时,需水浴加热,实验台附近严禁火源6. 验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
A、该反应为可逆反应,及时将生成的水移除反应体系可提高产率 B、用乙醚萃取苯甲酸乙酯时,有机相位于分液漏斗的下层 C、冷水和Na2CO3溶液洗涤的目的是除去浓硫酸和未反应的苯甲酸 D、蒸馏除去乙醚时,需水浴加热,实验台附近严禁火源6. 验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。①
②
③
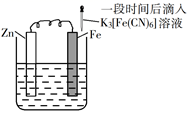
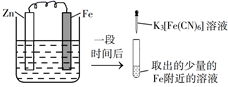
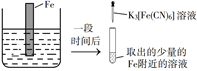
在Fe表面生成蓝色沉淀
试管内无明显变化
试管内生成蓝色沉淀
下列说法错误的是( )
A、对比②③,可以判定Zn保护了Fe B、对比①②,K3[Fe(CN)6]可能将Fe氧化 C、验证Zn保护Fe时不能用①的方法 D、将Zn换成Cu,用①的方法可判断Fe比Cu活泼7. 是制备电池的重要原料。室温下, 溶液的pH随 的变化如图甲所示, 溶液中 的分布分数 随pH的变化如图乙所示 。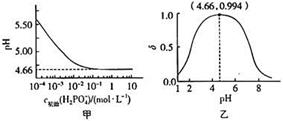
下列有关 溶液的叙述正确的是
A、溶液中存在3个平衡 B、含P元素的粒子有 、 和 C、随 增大,溶液的pH明显变小 D、用浓度大于 的 溶液溶解 ,当pH达到 时, 几乎全部转化为二、综合题
-
8. 2-硝基-1,3-苯二酚是重要的医药中间体。实验室常以间苯二酚为原料,经磺化、硝化、去磺酸基三步合成:
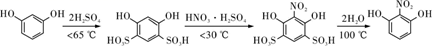
部分物质相关性质如下表:
名称
相对分子质量
性状
熔点/℃
水溶性(常温)
间苯二酚
110
白色针状晶体
110.7
易溶
2-硝基-1,
3-苯二酚
155
桔红色针状晶体
87.8
难溶
制备过程如下:
第一步:磺化。称取77.0 g间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内搅拌15 min(如图1)。
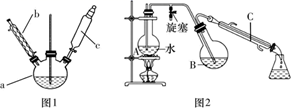
第二步:硝化。待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅拌15 min。
第三步:蒸馏。将硝化反应混合物的稀释液转移到圆底烧瓶B中,然后用如图2所示装置进行水蒸气蒸馏(水蒸气蒸馏可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的),收集馏出物,得到2-硝基-1,3-苯二酚粗品。
请回答下列问题:
(1)、图1中仪器a的名称是;磺化步骤中控制温度最合适的范围为(填字母代号,下同)。A.30~60℃ B.60~65℃
C.65~70℃ D.70~100℃
(2)、已知:酚羟基邻对位的氢原子比较活泼,均易被取代。请分析第一步磺化引入磺酸基基团(—SO3H)的作用是。(3)、硝化步骤中制取“混酸”的具体操作是。(4)、水蒸气蒸馏是分离和提纯有机物的方法之一,被提纯物质必须具备的条件正确的是___________。A、具有较低的熔点 B、不溶或难溶于水,便于最后分离 C、难挥发性 D、在沸腾下与水不发生化学反应(5)、下列说法正确的是___________。A、直型冷凝管内壁中可能会有红色晶体析出 B、反应一段时间后,停止蒸馏,先熄灭酒精灯,再打开旋塞,最后停止通冷凝水 C、烧瓶A中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能防止压强过小引起倒吸(6)、蒸馏所得2-硝基-1,3-苯二酚中仍含少量杂质,可用少量乙醇水混合剂洗涤。请设计简单实验证明2-硝基-1,3-苯二酚已经洗涤干净。(7)、本实验最终获得15.5 g桔红色晶体,则2-硝基-1,3-苯二酚的产率约为(保留3位有效数字)。9. 铈是稀土中丰度最高的元素,其在电子材料、催化剂等方面的应用广泛。现以氟碳铈矿(含CeFCO3、BaO、SiO2等)为原料制备氧化铈(CeO2),并测定其纯度。其工艺流程如下:
已知:①稀土离子易和SO 形成复盐沉淀:
Ce2(SO4)3+Na2SO4+nH2O= Ce2(SO4)3·Na2SO4·nH2O↓(复盐沉淀);
②硫脲:一种有机物,结构简式为
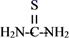 ,酸性条件下易被氧化为(SCN2H3)2;
,酸性条件下易被氧化为(SCN2H3)2;③Ce3+在空气中易被氧化为Ce4+;
回答下列问题:
(1)、焙烧时,为了提高焙烧效率,可采取的措施有(2)、CeFCO3中Ce元素的化合价为 , 滤渣A的主要成分是(3)、焙烧后加入硫酸浸出,稀土的浸出率和硫酸浓度、温度有关,如图所示,应选择的适宜的条件为 , 硫酸浓度过大时,浸出率减小的原因是。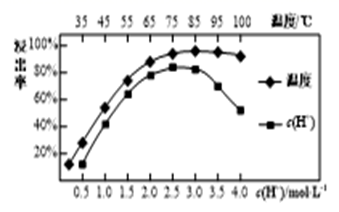 (4)、加入硫脲的目的是将Ce4+还原为Ce3+ , 反应的化学方程式为。(5)、步骤③加入盐酸后,通常还需加入H2O2 , 其主要目的为。(6)、步骤④的离子方程式为。(7)、取所得产品CeO2 8.0g,用30 mL高氯酸和20 mL磷酸混合液加热溶解,冷却至室温后,配成250 mL溶液。取25.00 mL溶液用0.2000 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,已知滴定时发生的反应为Fe2++Ce4+=Fe3++Ce3+ , 达到滴定终点时消耗硫酸亚铁铵溶液20.50 mL,则该产品的纯度为。10. 利用NH3可有效消除氮氧化物的污染,还自然“绿水青山”。
(4)、加入硫脲的目的是将Ce4+还原为Ce3+ , 反应的化学方程式为。(5)、步骤③加入盐酸后,通常还需加入H2O2 , 其主要目的为。(6)、步骤④的离子方程式为。(7)、取所得产品CeO2 8.0g,用30 mL高氯酸和20 mL磷酸混合液加热溶解,冷却至室温后,配成250 mL溶液。取25.00 mL溶液用0.2000 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,已知滴定时发生的反应为Fe2++Ce4+=Fe3++Ce3+ , 达到滴定终点时消耗硫酸亚铁铵溶液20.50 mL,则该产品的纯度为。10. 利用NH3可有效消除氮氧化物的污染,还自然“绿水青山”。已知:
Ⅰ.2H2(g)+O2(g)=2H2O(g)DH1=-483.6kJ·mol-1
Ⅱ.N2(g)+O2(g)=2NO(g)DH2=+180.5kJ·mol-1
回答下列问题:
(1)、在刚性容器中,发生反应Ⅲ:2H2(g)+2NO(g) N2(g)+2H2O(g)DH①DH=kJ·mol-1。
②恒温恒压时,下列能说明该反应已达到化学平衡状态的是(填标号)。
A.v逆(NO)=2v正(N2)
B.混合气体的密度不再变化
C.容器内总压强不再改变
D.混合气体的平均相对分子质量不再变化
(2)、我国科学研究工作者在刚性容器中按投料比 =1发生反应Ⅲ,不同催化剂条件下,反应相同时间测得NO的转化率与温度的关系,如图。
①催化剂为FeNb0.4Ox时,试分析温度大于350℃时,NO转化率降低的原因是。
②研究表明该反应v=kcm(H2)c2(NO),其中k为速率常数,与温度、活化能有关。若初始速率为r,当H2转化率为50%时,反应速率为 r,由此可知m=。设该反应的活化能为Ea , 不同温度T1、T2条件下对应的速率常数分别为k1、k2 , 存在下列关系:lg = ( ﹣ )(R为常数)。据此推测升高温度时,活化能大小与速率常数变化情况的关系:。
(3)、在30MPa、3m%的H2、m%的N2和q%的惰性气体条件进行反应N2(g)+3H2(g) 2NH3(g)DH<0合成氨气,测得平衡时,NH3体积分数变化情况如图。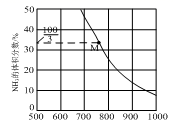
若q=10时,M点的N2的分压=MPa。此时该反应的压强平衡常数Kp=(MPa)-2(保留三位有效数字)(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
11. Fe—Cr—Si系合金是一种新型耐磨耐腐蚀的材料,具有较好的发展前景。按要求回答下列问题。(1)、基态Cr2+与Fe的未成对电子数之比为。试从电子排布角度分析水溶液中Fe2+具有强还原性。若是形成将其转化为(NH4)2Fe(SO4)2 , 在空气中相对稳定, 的空间构型为。(2)、由环戊二烯(C5H6 , )与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知 的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为 , 结构中的大π键可用符号表示 ,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。则 结构中含有的大π键可表示为。 (3)、某含铬配合物,[Cr3O(CH3COO)6(H2O)3]Cl·8H2O,指出其中Cr的化合价为。几种Cr的卤化物的部分性质如表所示:
)与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知 的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为 , 结构中的大π键可用符号表示 ,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。则 结构中含有的大π键可表示为。 (3)、某含铬配合物,[Cr3O(CH3COO)6(H2O)3]Cl·8H2O,指出其中Cr的化合价为。几种Cr的卤化物的部分性质如表所示:卤化物
CrCl3
CrBr3
CrI3
熔点/℃
1150
600
试预测CrBr3的熔点范围。
(4)、某晶体中含有K+、Ni2+、Fe2+、CN- , 其部分微粒在晶胞结构的位置如图所示。1个晶胞中含有CN-个。该物质常用于吸附Cs+ , 将取代晶胞中的K+ , 取代后的物质的化学式为。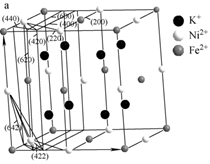 12. 曲美布汀是一种消化系统药物的有效成分,能缓解各种原因引起的胃肠痉挛,可通过以下路线合成。
12. 曲美布汀是一种消化系统药物的有效成分,能缓解各种原因引起的胃肠痉挛,可通过以下路线合成。
已知:R—CN R—COOH
回答下列问题:
(1)、A的名称是 , 反应⑤的反应类型是。(2)、写出F的结构简式并用星号(*)标出手性碳原子。(3)、下列有关说法正确的是(填标号)。a.反应①需用铁粉作催化剂
b.曲美布汀的含氧官能团为酯基和醚键
c.E中所有碳原子可处于同一平面
d.化合物G能发生取代反应、加成反应和消去反应
(4)、反应⑦的化学方程式为。(5)、化合物M是E的同分异构体,符合下列条件的M的可能结构有种。其中核磁共振氢谱为五组峰的结构简式为。i.M为苯的二元取代物
ii.既能发生银镜反应又能发生水解反应
(6)、参照上述合成路线,以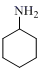 和OCH—CH2—CH2—CH2—CHO为原料,设计制备
和OCH—CH2—CH2—CH2—CHO为原料,设计制备  的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。