2021年高考理综化学真题试卷(全国乙卷)
试卷更新日期:2021-06-10 类型:高考真卷
一、选择题:本题共13小题,毎小题6分,共78分.
-
1. 我国提出争取在2030年前实现碳达峰、2060年前实现碳中和,这对于改善环境、 实现绿色发展至关重要。“碳中和”是指CO2的排放总量和减少总量相当。下列措施中能促进碳中和最直接有效的是( )A、将重质油裂解为轻质油作为燃料 B、大规模开采可燃冰作为新能源 C、通过清洁煤技术减少煤燃烧污染 D、研发催化剂将 还原为甲醇2. 在实验室釆用如图装置制备气体,合理的是( )
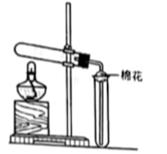
化学试剂
制备的气体
A
B
(浓)
C
D
(浓)
A、A B、B C、C3. 下列过程中的化学反应,相应的离子方程式正确的是( )A、用碳酸钠溶液处理水垢中的硫酸钙: CO32- +CaSO4 =CaCO3 + SO42- B、过量铁粉加入稀硝酸中:Fe + 4H+ + NO3- = Fe3+ +NO↑ +2H2O C、硫酸铝溶液中滴如少量氢氧化钾溶液: Al3+ +4 OH- =AlO2- + 2H2O D、氯化铜溶液中通入硫化氢: Cu2+ + S2- =CuS ↓4. 一种活性物质的结构简式为 ,下列有关该物质的叙述正确的是( ) A、能发生取代反应,不能发生加成反应 B、既是乙醇的同系物也是乙酸的同系物 C、与
,下列有关该物质的叙述正确的是( ) A、能发生取代反应,不能发生加成反应 B、既是乙醇的同系物也是乙酸的同系物 C、与 互为同分异构体
D、1mol该物质与碳酸钠反应得44 g
5. 我国嫦娥五号探测器带回1.731 kg的月球土壤,经分析发现其构成与地球土壤类似,土壤中含有的短周期元素W、X、Y、Z,原子序数依次増大,最外层电子数之和为 15。X、Y、Z为同周期相邻元素,且均不与W同族,下列结论正确的是( )A、原子半径大小顺序为W>X>Y>Z B、化合物XW中的化学健为离子键 C、Y单质的导电性能弱于Z单质的 D、Z的氧化物的水化物的酸性强于碳酸6. 沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排故并 降低冷却效率。为解决这一问题,通常在管道口设置一对情性电极(如图所示),通入一定的电流。
互为同分异构体
D、1mol该物质与碳酸钠反应得44 g
5. 我国嫦娥五号探测器带回1.731 kg的月球土壤,经分析发现其构成与地球土壤类似,土壤中含有的短周期元素W、X、Y、Z,原子序数依次増大,最外层电子数之和为 15。X、Y、Z为同周期相邻元素,且均不与W同族,下列结论正确的是( )A、原子半径大小顺序为W>X>Y>Z B、化合物XW中的化学健为离子键 C、Y单质的导电性能弱于Z单质的 D、Z的氧化物的水化物的酸性强于碳酸6. 沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排故并 降低冷却效率。为解决这一问题,通常在管道口设置一对情性电极(如图所示),通入一定的电流。下列叙述错误的是( )
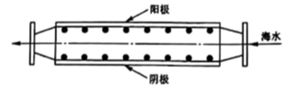 A、阳极发生将海水中的 氧化生成 的反应 B、管道中可以生成氧化灭杀附着生物的NaClO C、阴极生成的 应及时通风稀释安全地排入大气 D、阳极表面形成的Mg 等积垢需要定期清理7. HA是一元弱酸,难溶盐MA的饱和溶液中 而变化, 不发生水解。实验发现,298K时 ,如下图中实线所示。
A、阳极发生将海水中的 氧化生成 的反应 B、管道中可以生成氧化灭杀附着生物的NaClO C、阴极生成的 应及时通风稀释安全地排入大气 D、阳极表面形成的Mg 等积垢需要定期清理7. HA是一元弱酸,难溶盐MA的饱和溶液中 而变化, 不发生水解。实验发现,298K时 ,如下图中实线所示。下列叙述错误的是( )
 A、溶液pH = 4 时. B、MA 的溶度积 C、溶液 pH = 7 时, D、HA 的电离常数
A、溶液pH = 4 时. B、MA 的溶度积 C、溶液 pH = 7 时, D、HA 的电离常数二、必考题:共129分
-
8. 磁选后的炼铁高钛炉渣,主要成分有 、 、 、MgO、CaO以及少量的 ,为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。

该工艺下,有关金属离子开始沉淀和沉淀完全的pH见下表:
金属离子
开始沉淀的pH
2.2
3.5
9.5
12.4
沉淀完全(c=1.0×10*mol-L')的pH
3.2
4.7
11.1
13.8
回答下列问题:
(1)、“焙烧”中, 、 几乎不发生反应, 、MgO、CaO、 转化为相应的硫酸盐,写出 转化为 的化学方程式。(2)、“水浸”后“滤液”的pH约为2.0,在“分步沉淀”氨水逐步调节pH至11.6,依次析出的金属离子是。(3)、“母液①”中 浓度为mol·(4)、”水浸渣”在160℃“酸溶”,最适合的酸是。“酸溶渣”的成分是、。(5)、“酸溶”后,将溶液适当稀释并加热, 水解析出 沉淀,该反应的离子方程式是。(6)、将“母液①”和“母液②”混合,吸收尾气,经处理得 , 循环利用。9. 氧化石墨烯具有稳定的网状结构,在能源、材料等领域有着重要的应用前景,通过氧化剥离石墨制备氧化石墨烯的一种方法如下(装置如图所示):
I.将浓H2SO4、NaNO3、石墨粉末在c中混合,置于冰水浴中。剧烈搅拌下,分批缓慢加入KMnO4粉末,塞好瓶口。
II.转至油浴中,35℃搅拌1小时,缓慢滴加一定量的蒸馏水。升温至98℃并保持1小时。
III.转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加H2O2至悬浊液由紫色变为土黄色。
IV.离心分离,稀盐酸洗涤沉淀。
V.蒸馏水洗涤沉淀。
VI.冷冻干燥,得到土黄色的氧化石墨烯。
回答下列问题:
(1)、装置图中,仪器a、c的名称分别是、 , 仪器b的进水口是(填字母)。(2)、步骤I中,需分批缓慢加入KMnO4粉末并使用冰水浴,原因是.(3)、步骤II中的加热方式采用油浴,不使用热水浴,原因是_.(4)、步骤III中,H2O2的作用是(以离子方程式表示).(5)、步骤IV中,洗涤是否完成,可通过检测洗出液中是否存在SO42-来判断。检测的方法是.(6)、步骤V可用pH试纸检测来判断Cl-是否洗净,其理由是.10. 一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:(1)、历史上海藻提碘中得到一种红棕色液体,由于性质相似,Liebig误认为是ICl,从而错过了一种新元素的发现。该元素是.(2)、氯铂酸钡(BaPtCl6)固体加热时部分分解为BaCl2、Pt和Cl2 , 376.8℃时平衡常数K‘p=1.0x104Pa2。在一硬质玻璃烧瓶中加入过量BaPtCl6 , 抽真空后,通过一支管通入碘蒸气(然后将支管封闭)。在376.8℃,碘蒸气初始压强为20.0kPa.376.8℃平衡时,测得烧瓶中压强为32.5kPa,则PICl=kPa,反应2ICl(g)=Cl2(g)+I2(g)的平衡常数K=(列出计算式即可).(3)、McMorris 测定和计算了在136-180℃范围内下列反应的平衡常数KP :2NO(g)+2ICl(g) 2NOCl(g)+I2(g) KP1
2NOCl(g) 2NO(g)+Cl2(g) KP2
得到lgKP1 和lgKP2 均为线性关系,如下图所示:

①由图可知,NOCl分解为NO和Cl2反应的ΔH0(填“大于”或“小于”).
②反应2ICl(g)=Cl2(g)+I2(g)的K=(用KP1、KP2表示):该反应的ΔH0(填“大于”或“小于”),写出推理过程.
(4)、Kistiakowsky曾研究了NOCl光化学分解反应,在一定频率(v)光的照射下机理为:NOCl+hv→NOC*
NOCl+NOCl*→2NO+Cl2
其中hv表示一个光子能量,NOCl*表示NOCl的激发态。可知,分解1mol的NOCl需要吸收mol的光子。
三、选考题
-
11. [化学——选修3:物质结构与性质]
过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用,回答下列问题:
(1)、对于基态Cr原子,下列叙述正确的是(填标号)。A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar] 3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)、三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是 , 中心离子的配位数为。(3)、[Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如下图所示。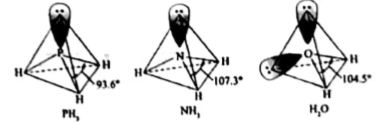
PH3中P的杂化类型是 , NH3的沸点比PH3的 , 原因是。H2O的键角小于NH3的,分析原因。
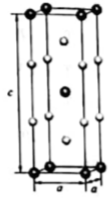
(4)、在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示。处于顶角位置的是原子。设Cr和Al原子半径分别为 和 ,则金属原子空间占有率为%(列出计算表达式)。12. 卤沙唑仑W是一种抗失眠药物,在医药工业中的一种合成方法如下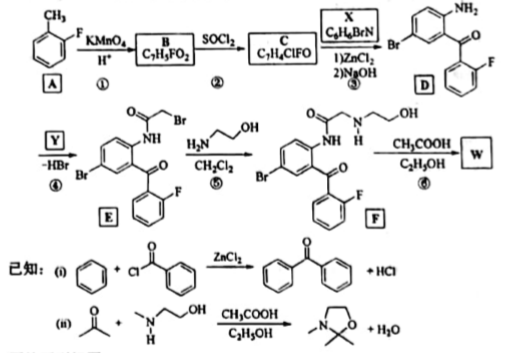
回答下列问题:
(1)、A的化学名称是。(2)、写出反应③的化学方程式。(3)、D具有的官能团名称是。(不考虑苯环)(4)、反应④中,Y的结构简式为。(5)、反应⑤的反应类型是。(6)、C的同分异构体中,含有苯环并能发生银镜反应的化合物共有种。(7)、写出W的结构简式。