安徽省2021年中考化学模拟试卷
试卷更新日期:2021-06-08 类型:中考模拟
一、本大题包括12小题,每小题1分,共12分。每小题的4个选项中只有1个符合题意。
-
1. 安徽历史文化闻名全国,下列艺术品制作过程涉及化学变化的是( )A、芜湖铜质鸠兹
 B、徽雕
B、徽雕  C、马鞍山丝画
C、马鞍山丝画  D、宣城宣纸
D、宣城宣纸  2. 下列做法不利于环境保护的是( )A、提倡生活垃圾分类回收并利用 B、鼓励使用一次性筷子 C、提倡使用农家肥提高作物产量 D、提倡购买使用电动汽车3. 在酒精运输车上应张贴的标志是( )A、
2. 下列做法不利于环境保护的是( )A、提倡生活垃圾分类回收并利用 B、鼓励使用一次性筷子 C、提倡使用农家肥提高作物产量 D、提倡购买使用电动汽车3. 在酒精运输车上应张贴的标志是( )A、 B、
B、 C、
C、 D、
D、 4. 食品安全与人体健康息息相关,下列生活中的饮食观点正确的是( )A、食用加碘食盐,可以预防甲状腺肿大 B、为勤俭节约,可用地沟油烹炸食品 C、油脂会引起肥胖,我们可以不补充油脂 D、保健品可补充必需元素,吃越多越好5. Al-CO2电池是一种新型电池,其工作原理如下:在O2的催化下,Al与CO2发生化合反应生成Al2(C2O4)3。下列关于Al2(C2O4)3的说法正确的是是( )A、由一种金属和两种非金属组成 B、铝、碳、氧元素质量比为1∶3∶6 C、碳元素的化合价为+3 D、Al2(C2O4)3中原子总数为206. 以下实验基本操作正确的是( )A、加热液体
4. 食品安全与人体健康息息相关,下列生活中的饮食观点正确的是( )A、食用加碘食盐,可以预防甲状腺肿大 B、为勤俭节约,可用地沟油烹炸食品 C、油脂会引起肥胖,我们可以不补充油脂 D、保健品可补充必需元素,吃越多越好5. Al-CO2电池是一种新型电池,其工作原理如下:在O2的催化下,Al与CO2发生化合反应生成Al2(C2O4)3。下列关于Al2(C2O4)3的说法正确的是是( )A、由一种金属和两种非金属组成 B、铝、碳、氧元素质量比为1∶3∶6 C、碳元素的化合价为+3 D、Al2(C2O4)3中原子总数为206. 以下实验基本操作正确的是( )A、加热液体 B、用于分离二氧化锰和水
B、用于分离二氧化锰和水  C、点燃酒精灯
C、点燃酒精灯  D、检查气密性
D、检查气密性  7. 联合国将2019年列为“国际化学元素周期表年”。镁、锶元素在元素周期表中的部分信息及原子结构示意图如图,下面说法正确的是( )
7. 联合国将2019年列为“国际化学元素周期表年”。镁、锶元素在元素周期表中的部分信息及原子结构示意图如图,下面说法正确的是( ) A、这两种元素的化学性质差异很大 B、锶原子的中子数为38 C、锶的氧化物化学式为SrO D、镁的相对原子质量为24.31 g8. 北斗系统的全面建成彰显了中国航天的力量。在航天科技中会用到大量金属材料,下列有关金属材料的说法正确的是( )A、合金中一定只含金属元素 B、纯铜比黄铜的硬度更大 C、生锈的钢铁制品没有回收价值 D、钛和钛合金被广泛用于火箭、导弹等9. 利用催化剂可消除室内装修材料释放的甲醛,如图所示为该反应的微观示意图,下列说法不正确的是( )
A、这两种元素的化学性质差异很大 B、锶原子的中子数为38 C、锶的氧化物化学式为SrO D、镁的相对原子质量为24.31 g8. 北斗系统的全面建成彰显了中国航天的力量。在航天科技中会用到大量金属材料,下列有关金属材料的说法正确的是( )A、合金中一定只含金属元素 B、纯铜比黄铜的硬度更大 C、生锈的钢铁制品没有回收价值 D、钛和钛合金被广泛用于火箭、导弹等9. 利用催化剂可消除室内装修材料释放的甲醛,如图所示为该反应的微观示意图,下列说法不正确的是( ) A、甲醛的化学式为CH2O B、生成物丙和丁中氧元素的化合价相同 C、生成物丙由1个碳原子和2个氧原子构成 D、参加反应的甲和生成的丁分子个数比为1∶110. 化学与人类的生活密切相关。下列对化学知识的应用归纳完全正确的一组是( )
A、甲醛的化学式为CH2O B、生成物丙和丁中氧元素的化合价相同 C、生成物丙由1个碳原子和2个氧原子构成 D、参加反应的甲和生成的丁分子个数比为1∶110. 化学与人类的生活密切相关。下列对化学知识的应用归纳完全正确的一组是( )A.化学与能源
B.化学与安全
①太阳能、煤、石油、天然气都是可再生资源
②我国试采新能源“可燃冰”已经成功
①在室内放一盆水能防止煤气中毒
②用大量的甜蜜素制作果冻,使它更加可口
C.化学与生活
D.化学与环境
①铵盐在农业生产中常用作氮肥,使用时不能与石灰、草木灰混合
②用灼烧闻气味的方法区别棉纤维和羊毛纤维
①目前,二氧化碳、臭氧等物质计入“空气污染指数”
②使用可降解的塑料可减少“白色污染”
A、A B、B C、C D、D11. 如图是a、b、c三种物质的溶解度曲线,下列说法正确的是( )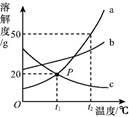 A、P点表示t1 ℃时,a、c两种物质的溶液的质量相等 B、t2 ℃时,a的饱和溶液的溶质质量分数为50% C、t2 ℃时,将等质量的a、b、c三种物质配制成饱和溶液,所需水的质量最少的为a D、将t2 ℃时a、b、c三种物质的饱和溶液降温至t1 ℃,变为不饱和溶液的是a12. 利用如图1装置探究物质燃烧,点燃蜡烛后立即塞紧橡胶塞,待蜡烛熄灭后,将滴管中的水全部滴入集气瓶中,生石灰遇水放出大量的热,使铝盒中的白磷立即燃烧。如图2是瓶中二氧化碳和氧气的含量随时间变化的图像。下列有关说法错误的是( )
A、P点表示t1 ℃时,a、c两种物质的溶液的质量相等 B、t2 ℃时,a的饱和溶液的溶质质量分数为50% C、t2 ℃时,将等质量的a、b、c三种物质配制成饱和溶液,所需水的质量最少的为a D、将t2 ℃时a、b、c三种物质的饱和溶液降温至t1 ℃,变为不饱和溶液的是a12. 利用如图1装置探究物质燃烧,点燃蜡烛后立即塞紧橡胶塞,待蜡烛熄灭后,将滴管中的水全部滴入集气瓶中,生石灰遇水放出大量的热,使铝盒中的白磷立即燃烧。如图2是瓶中二氧化碳和氧气的含量随时间变化的图像。下列有关说法错误的是( ) A、曲线①是二氧化碳变化,曲线②是氧气变化 B、在t1至t2时间段内蜡烛已熄灭而白磷还没有开始燃烧 C、该实验证明了蜡烛燃烧生成的二氧化碳气体仍能支持白磷的燃烧 D、该实验证明了不同物质的燃烧对氧气的质量分数需求不同
A、曲线①是二氧化碳变化,曲线②是氧气变化 B、在t1至t2时间段内蜡烛已熄灭而白磷还没有开始燃烧 C、该实验证明了蜡烛燃烧生成的二氧化碳气体仍能支持白磷的燃烧 D、该实验证明了不同物质的燃烧对氧气的质量分数需求不同二、本大题包括5小题,共28分。
-
13. 阅读下列短文,回答问题。
改革开放以来,我国的经济实力不断增强,科学技术也在不断进步,勤劳的中国人民创造出一个个奇迹。近年来,中国高铁成为“中国制造”在海外最闪亮的“名片”。如今,中国高铁已经把版图扩展到了亚、欧、非、美等五大洲数十个国家,并与日本等老牌高铁强国分庭抗礼,甚至技高一筹。高铁系统主要由玻璃车窗、喷漆车身、钢轨等组成。
(1)、文中涉及的金属元素是(填元素符号,一种即可)。(2)、高铁酸钠(Na2FeO4)是高铁上常用的一种绿色、环保、高效的消毒剂。高铁酸钠中铁元素的化合价为;制备Na2FeO4的反应原理是Fe2O3+3NaNO3+4NaOH=2Na2FeO4+3NaNO2+2X,其中X的化学式为。(3)、修建铁路需要大量的钢铁,工业上用赤铁矿炼铁的化学方程式为。14. 气体的制取、收集和除杂是初中化学的重要内容之一。请结合下列化学实验装置,回答有关问题: (1)、写出指定的仪器名称:①。(2)、写出实验室用过氧化氢制取氧气的化学方程式:;该实验应选用的装置是(填字母序号)。(3)、制取和收集二氧化碳可以选择B装置,该装置制取二氧化碳的优点是。(4)、制得的二氧化碳中常含有少量氯化氢气体和水蒸气,将制得的气体依次通过装置G和装置F后,可得到较为纯净的二氧化碳,其中,装置F和G不能颠倒顺序的原因是。15. 纳米碳酸钡是一种重要的无机化工产品,如图是生产纳米碳酸钡的工艺流程。请回答下列问题:
(1)、写出指定的仪器名称:①。(2)、写出实验室用过氧化氢制取氧气的化学方程式:;该实验应选用的装置是(填字母序号)。(3)、制取和收集二氧化碳可以选择B装置,该装置制取二氧化碳的优点是。(4)、制得的二氧化碳中常含有少量氯化氢气体和水蒸气,将制得的气体依次通过装置G和装置F后,可得到较为纯净的二氧化碳,其中,装置F和G不能颠倒顺序的原因是。15. 纳米碳酸钡是一种重要的无机化工产品,如图是生产纳米碳酸钡的工艺流程。请回答下列问题: (1)、将固体A和溶液B分离的操作为。(2)、加入过量稀盐酸的目的是。(3)、写出生成固体A的化学方程式: , 反应的基本类型是。(4)、写出气体A的一种用途:。16. 科学探究和证据推理是化学学科的核心素养。学习小组对蓝绿色碱式碳酸铜晶体[Cu2(OH)2CO3]的性质进行实验探究,并基于证据进行推理分析。(1)、Ⅰ.探究碱式碳酸铜受热的变化
(1)、将固体A和溶液B分离的操作为。(2)、加入过量稀盐酸的目的是。(3)、写出生成固体A的化学方程式: , 反应的基本类型是。(4)、写出气体A的一种用途:。16. 科学探究和证据推理是化学学科的核心素养。学习小组对蓝绿色碱式碳酸铜晶体[Cu2(OH)2CO3]的性质进行实验探究,并基于证据进行推理分析。(1)、Ⅰ.探究碱式碳酸铜受热的变化【设计实验】学习小组设计了如图装置(夹持仪器已略去),并用于探究碱式碳酸铜的分解产物。

注:无水硫酸铜为白色固体,遇水变蓝。
【实验过程】①在装置丙导管a处连接一导管,并插入水中,微热试管,观察到 , 说明整套装置的气密性良好。
②按图示加入样品和试剂,加热一段时间后,试管中固体变黑,澄清石灰水变浑浊。
(2)、【实验分析】①装置乙中的现象是。②装置丙中发生反应的化学方程式为。
③根据现象可知,碱式碳酸铜受热可分解,分解产物有CO2、CuO、。
④装置乙、丙位置不能互换的理由是。
(3)、Ⅱ.探究碱式碳酸铜与酸的作用【实验过程】取少量样品于试管中,加水,固体不溶解。继续加入足量稀硫酸,有气泡产生,得到蓝色溶液。
【实验结论】碱式碳酸铜能与硫酸发生反应,生成的盐为。
(4)、【拓展延伸】碱式盐在生活中应用广泛。碱式氯化铝[Al2(OH)Cl5]是一种高效净水剂。写出碱式氯化铝与盐酸发生反应的化学方程式:。17. 某实验小组为测定铜和氧化铜的混合物中铜元素的含量,取20 g该固体混合物,向其中逐滴加入稀H2SO4 , 测得剩余固体的质量与加入稀H2SO4的质量关系如图所示。回答下列问题: (1)、该固体混合物中铜元素的质量为;(2)、计算稀H2SO4中溶质的质量分数(写出计算过程)。
(1)、该固体混合物中铜元素的质量为;(2)、计算稀H2SO4中溶质的质量分数(写出计算过程)。