高中化学鲁科版(2019)选择性必修2 第3章测试卷
试卷更新日期:2021-06-08 类型:单元试卷
一、单选题
-
1. 下列说法正确的是( )A、冰和氯化钠融化时克服的作用力均为分子间作用力 B、某物质在熔融态能导电,则该物质中一定含有离子键 C、CCl4和CO2两种分子中,每个原子的最外层都具有8电子稳定结构 D、金刚石、C60都不存在单个小分子2. 熔融时需要破坏共价键的化合物是( )A、冰 B、石英 C、金刚石 D、氢氧化钠3. 下列晶体中,①冰 ②石英 ③足球烯(C60) ④食盐 ⑤白磷 ⑥冰醋酸 ⑦晶体氩。晶体中除了存在原子与原子间的共价键外,同时也存在范德华力的有( )A、3种 B、4种 C、5种 D、6种4. 下列有关离子晶体的数据大小比较错误的是( )A、熔点:NaF>MgF2>AlF3 B、晶格能:NaF>NaCl>NaBr C、阴离子的配位数:CsCl>NaCl>CaF2 D、硬度:MgO>CaO>BaO5. 下列说法正确的是( )A、氯化钠晶体熔融时需要克服离子键 B、石英和干冰都属于原子晶体 C、CH4、CO2中所有原子均满足最外层8 电子稳定结构 D、KOH和 CaCl2 都是含有共价键的离子化合物6. 随着工业生产和社会发展对材料性能要求的提高,无机非金属材料成为高技术领域必须材料。下列说法错误的是( )A、高纯度的硅可用于制造计算机芯片 B、用氢氟酸可以生产磨砂玻璃 C、工业上利用硅的高熔点可以用物理方法制得高纯度硅 D、碳纳米管表面积大、强度高,可用于生产感应器7. 制备纳米Fe3O4的过程如下:下列有关叙述不合理的是( )
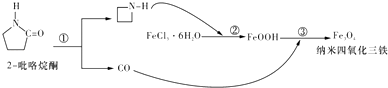 A、纳米Fe3O4分散在适当溶剂中,当强光照射时,会产生丁达尔现象 B、反应①的反应类型为消去反应 C、反应②中,环丙胺的作用可能是促进氯化铁水解 D、反应③的化学方程式为:6FeOOH+CO═2Fe3 O4+3H2O+CO28. “纳米材料”是粒子直径为1nm~100nm的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀的分散到蒸馏水中,得到的分散系①是溶液②是胶体③具有丁达尔现象④不能透过半透膜⑤不能透过滤纸⑥静置后会出现黑色沉淀。其中正确的是( )A、①④⑥ B、②③⑤ C、②③④ D、①③④⑥
A、纳米Fe3O4分散在适当溶剂中,当强光照射时,会产生丁达尔现象 B、反应①的反应类型为消去反应 C、反应②中,环丙胺的作用可能是促进氯化铁水解 D、反应③的化学方程式为:6FeOOH+CO═2Fe3 O4+3H2O+CO28. “纳米材料”是粒子直径为1nm~100nm的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀的分散到蒸馏水中,得到的分散系①是溶液②是胶体③具有丁达尔现象④不能透过半透膜⑤不能透过滤纸⑥静置后会出现黑色沉淀。其中正确的是( )A、①④⑥ B、②③⑤ C、②③④ D、①③④⑥二、综合题
-
9. 根据问题填空:(1)、“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中.所谓“纳米材料”是指研究、开发出的微粒粒度从几纳米至几十纳米的材料,如将纳米材料分散到分散剂中,所得混合物可能具有的性质是 .A、能全部透过半透膜 B、有丁达尔效应 C、所得液体呈胶状 D、所得物质一定是悬浊液(2)、把淀粉溶液溶于沸水中,制成淀粉胶体,回答下列问题.
①鉴别水溶液和胶体可以利用的方法是 .
②60℃左右时,在淀粉胶体中加入淀粉酶,装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸镏水的烧杯里充分反应.从半透膜里析出的物质是 , 该操作的名称是 .
10. 硒(Se)是一种非金属元素。可以用作光敏材料、电解锰行业催化剂、动物体必需的营养元素和植物有益的营养元素等。请回答下列问题:(1)、Se元素基态原子的电子排布式为;第四周期中第一电离能比Se元素大的共有种(氪元素除外)。(2)、气态SeO3分子的价层电子对互斥模型为 ;SeO42-离子中Se原子的杂化方式为 。(3)、固态SeO2是以[SeO3]角锥体以角相连接的展平的聚合结构,每一锥体带有一悬垂的终端O原子(如下图1所示)。①图1中Se-O键键长较短的是 (填“a"或“b"),其原因是。
②SeO2熔点为350℃,固态SeO2属于晶体,其熔点远高于SO2(-75.5℃)的原因是 。
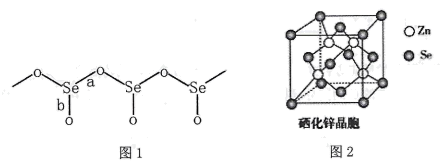 (4)、硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如上图2所示,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得ZnSe的晶胞参数a=0. 560nm,则Se2-的离子半径r(Se2-)= nm(计算结果保留3位有效数字,下同);硒化锌晶体的密度为 g.cm-3。11. B、Si和P 是组成半导体材料的重要元素。回答下列问题(1)、基态B、Si 和P中,单电子数最多的是 , 电负性最大的是。(2)、PCl3中心原子的杂化类型为 , BCl3与阴离子互为等电子体。(3)、SiCl4 极易与水反应,其反应机理如图。
(4)、硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如上图2所示,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得ZnSe的晶胞参数a=0. 560nm,则Se2-的离子半径r(Se2-)= nm(计算结果保留3位有效数字,下同);硒化锌晶体的密度为 g.cm-3。11. B、Si和P 是组成半导体材料的重要元素。回答下列问题(1)、基态B、Si 和P中,单电子数最多的是 , 电负性最大的是。(2)、PCl3中心原子的杂化类型为 , BCl3与阴离子互为等电子体。(3)、SiCl4 极易与水反应,其反应机理如图。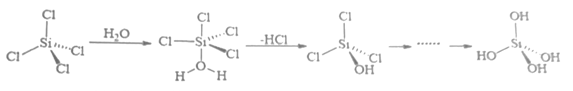
①上述反应机理涉及的分子中属于非极性分子的是。(填化学式)
②关于上述反应机理的说法正确的是。
A. Si 的杂化方式一直没有发生变化
B. H2O 中 O 通过孤对电子与 Si 形成配位键
C.只涉及了极性共价键的断裂与形成
(4)、两种含硅化合物的晶胞结构如图所示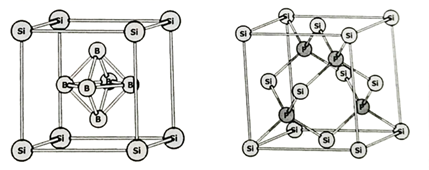
I Ⅱ
①这两种含硅化合物的化学式分别为和。
②I的晶胞参数为a pm,则Ⅰ的密度为 。
③Ⅱ的晶胞参数为b pm,Si和P的原子半径分别为 pm和 pm,则Ⅱ的空间占有率为。
12. 钙和铜合金可用作电解制钙的阴极电极材料,请回答下列问题:(1)、基态Cu的价电子排布式为。(2)、CaCO3高温分解可制得CaO。CaO与C在一定条件下可生成CaC2 , CaC2与水反应生成Ca(OH)2和一种四原子气体分子M。①CaCO3中阴离子的空间构型为。
②该气体分子M中σ键与π键的数目之比为。
(3)、工业上电解CaCl2制Ca而不用CaO,请从结构角度解释原因。(4)、在碱性溶液中,缩二脲HN(CONH2)2与CuSO4反应得到一种特征紫色物质,其结构如图所示,该反应原理可用于检验蛋白质或其他含肽键的化合物。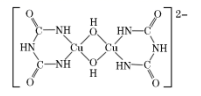
缩二脲分子中碳原子与氮原子的杂化类型分别为、。
(5)、一种钙铜合金的结构可看作图a、b两种原子层交替堆积排列而成c,其晶胞如图d。a图中Ca-Ca间距离为x pm,c图中Ca-Ca间距离距离为ypm。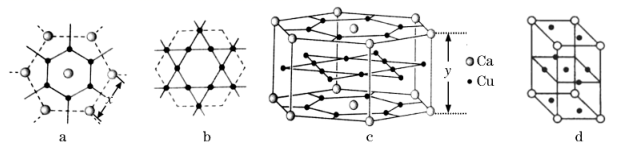
①已知原子拥有的尽可能多的相邻原子的个数叫该原子的配位数,则晶胞c中Ca原子的配位数(Cu原子)为。
②设阿伏加德罗常数为NA , 则该钙铜合金的密度是g/cm3(列出计算表达式)。
13. 有下列八种晶体:A 水晶(SiO2)、B 冰醋酸、C 氧化镁、D 白磷(P4)、E 干冰(CO2)、F氯化铵、G 铝、H 金刚石。回答下列问题:(1)、属于原子晶体的化合物是(填字母,下同),受热熔化后化学键不发生变化的是。(2)、1mol SiO2 含有mol Si—O 键,1mol 白磷(P4)含有mol P—P 键。(3)、从原子半径大小角度解释,同一主族的 C 与 Si,形成 CO2 和 SiO2 时,C、O 原子间 能形成π键,而 Si、O 之间不能的原因。(4)、升高温度,金属铝的电导率(填“升高”、“降低”或“不变”)。