高中化学鲁科版(2019)选择性必修2 第3章第3节 液晶、纳米材料与超分子
试卷更新日期:2021-06-08 类型:同步测试
一、单选题
-
1. 纳米金即指金的微小颗粒,具有高电子密度、介电特性和催化作用,能与多种生物大分子结合,且不影响其生物活性。由氯金酸通过还原法可以方便地制备各种不同粒径的纳米金,其颜色依直径大小而呈红色至紫色,在微生物检测、农药残留等方面应用广泛。下列关于纳米金的叙述中,错误的是( )A、纳米金是一种新型化合物 B、纳米金颗粒比普通金更易与氧气发生反应 C、纳米金与普通金所含金原子的质子数相同 D、纳米金分散在水中能产生丁达尔效应2. 开发新材料是现代科技发展的方向之一。下列有关材料的说法正确的是( )A、氮化硅陶瓷是新型无机非金属材料 B、C60属于原子晶体,用于制造纳米材料 C、纤维素乙酸酯属于天然高分子材料 D、单晶硅常用于制造光导纤维3. 2016年诺贝尔化学奖授予在合成分子机器领域做出贡献的三位科学家。分子机器是一种特殊的超分子体系,当体系受到外在刺激(如pH变化、吸收光子、电子得失等)时,分子组分间原有作用被破坏,各组分间发生类似于机械运动的某种热运动。下列说法错误的是( )A、驱动分子机器时,需要对体系输入一定的能量 B、分子状态的改变会伴随能量变化,属于化学变化 C、氧化还原反应有可能是刺激分子机器体系的因素之一 D、光照有可能使分子产生类似于机械运动的某种热运动4. 材料科学是以化学为基础的一门新兴热门学科,下列有关高中化学学习过的材料的描述错误的是( )A、纳米材料属于胶体 B、钢、铝合金属于金属材料 C、陶瓷、玻璃属于无机非金属材料 D、聚乙烯、蛋白质属于有机高分子材料5. 科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图。W、X、Z分别位于不同周期,Z的原子半径在同周期元素中最大。(注:实线代表共价键,其他重复单元的W、X未标注)下列说法错误的是( )
 A、Y单质的氧化性在同主族中最强 B、离子半径:Z>Y C、Z与Y可组成多种离子化合物 D、氢化物的热稳定性:Y>X6. 纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜”的有关叙述正确的是( )A、常温下“纳米铜”比铜片的还原性强,反应时反应速率快 B、“纳米铜”颗粒更细小,反应时接触面积大,反应速率快 C、“纳米铜”与铜是同素异形体 D、常温下“纳米铜”比铜片更易得电子,反应时反应速率快7. “纳米材料”(1nm=10﹣9m)已广泛应用于催化及军事科学中.“纳米材料”是指研究开发直径为几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中.有以下叙述:①所得物质一定是溶液,②能全部透过半透膜,③有丁达尔现象,④所得液体可以全部透过滤纸.对所得分散系的上述叙述正确的是( )A、①② B、②③ C、①④ D、③④8. 碳纳米管是由碳原子组成的六角形蜂巢状平面薄膜卷曲而成,具有许多异常的力学、电学和化学性能.下列关于碳纳米管的说法不正确的是( )
A、Y单质的氧化性在同主族中最强 B、离子半径:Z>Y C、Z与Y可组成多种离子化合物 D、氢化物的热稳定性:Y>X6. 纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜”的有关叙述正确的是( )A、常温下“纳米铜”比铜片的还原性强,反应时反应速率快 B、“纳米铜”颗粒更细小,反应时接触面积大,反应速率快 C、“纳米铜”与铜是同素异形体 D、常温下“纳米铜”比铜片更易得电子,反应时反应速率快7. “纳米材料”(1nm=10﹣9m)已广泛应用于催化及军事科学中.“纳米材料”是指研究开发直径为几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中.有以下叙述:①所得物质一定是溶液,②能全部透过半透膜,③有丁达尔现象,④所得液体可以全部透过滤纸.对所得分散系的上述叙述正确的是( )A、①② B、②③ C、①④ D、③④8. 碳纳米管是由碳原子组成的六角形蜂巢状平面薄膜卷曲而成,具有许多异常的力学、电学和化学性能.下列关于碳纳米管的说法不正确的是( ) A、碳纳米管属于一种有机合成纤维 B、碳纳米管与金刚石互为同素异形体 C、常温下,碳纳米管具有较好的稳定性 D、碳纳米管比表面积大,可用作新型储氢材料
A、碳纳米管属于一种有机合成纤维 B、碳纳米管与金刚石互为同素异形体 C、常温下,碳纳米管具有较好的稳定性 D、碳纳米管比表面积大,可用作新型储氢材料二、综合题
-
9.
液晶是一类新型材料.MBBA是一种研究得较多的液晶化合物.它可以看作是由醛A和胺B去水缩合的产物.
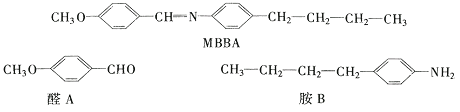 (1)、对位上有﹣C4H9的苯胺可能有4个异构体,它们是:(2)、醛A的异构体甚多.其中属于酯类化合物,而且结构式中有苯环结构的异构体就有6个,它们是:10. 在庆祝中华人民共和国成立 70 周年的阅兵仪式上,最后亮相的 DF—31 A 洲际战略
(1)、对位上有﹣C4H9的苯胺可能有4个异构体,它们是:(2)、醛A的异构体甚多.其中属于酯类化合物,而且结构式中有苯环结构的异构体就有6个,它们是:10. 在庆祝中华人民共和国成立 70 周年的阅兵仪式上,最后亮相的 DF—31 A 洲际战略导弹是我国大国地位 、国防实力的显著标志。其制作材料中包含了 Fe 、Cr 、Ni 、C 等多种元素。回答下列问题:
(1)、基态镍原子的价电子排布式为 。(2)、与 Cr 同周期且基态原子最外层电子数相同的元素,可能位于周期表中的区。(3)、铁元素能与CO形成 Fe (CO)5。羰基铁[ Fe (CO)5]可用作催化剂、汽油抗爆剂等。1 mol Fe(CO)5分子中含mol σ键,与CO互为等电子体的一种离子的化学式为。(4)、碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的 空隙和 空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B( ,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为。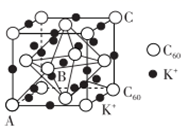 (5)、某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为a nm,高为c nm,阿伏加德罗常数的值为NA , 则该磁性氮化铁的晶体密度为_g/cm3( 列出计算式)。
(5)、某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为a nm,高为c nm,阿伏加德罗常数的值为NA , 则该磁性氮化铁的晶体密度为_g/cm3( 列出计算式)。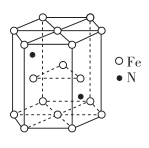 11. 化学元素形成的单质或化合物在工农业生产、军事国防、医疗生活各个领域发挥着重要的作用。(1)、钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82—+8H2O 2MnO4—+10SO42—+16H+
11. 化学元素形成的单质或化合物在工农业生产、军事国防、医疗生活各个领域发挥着重要的作用。(1)、钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82—+8H2O 2MnO4—+10SO42—+16H+①基态S原子核外有种不同空间运动状态的电子。
②已知H2S2O8的结构如图所示:
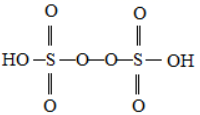
H2S2O8中硫原子的轨道杂化方式为;上述反应每生成1molMnO4— , S2O82—断裂的共价键类型及其数目分别为、(设阿伏加德罗常数的值为NA)
(2)、Fe可以与CN—、H2NCONH2(尿素)等多种配体形成配合物。①请写出与CN—互为等电子体的一种分子:、一种离子:。
②组成尿素的第二周期元素的第一电离能由大到小的顺序为: , 1molH2NCONH2(尿素)分子中含有σ键的数目为。
③FeN的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物Fe(x—n)CunNy。
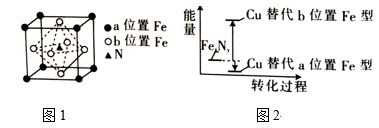
Cu处于周期表中区,其最高能层的符号为 , 基态铜原子的价电子排布式为。FexNy转化为两种Cu的替代型产物的能量变化如图2所示,其中相对不稳定的Cu替代型产物的化学式为。
(3)、铬是银灰色的结晶体,质硬而脆,是制造不锈钢、高速钢的重要原料。①CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是(填“极性”或“非极性”)分子
②CrCl3·6H2O实际上是配合物,配位数是6,其固体有三种颜色,其中一种浅绿色固体于足量硝酸银反应时,1mol固体可生成1molAgCl沉淀,则这种浅绿色固体中阳离子的化学式为。
12. 随着纳米技术的飞速发展,四氧化三铁纳米颗粒在磁性记录、磁流体、吸波、催化、医药等领域有着广泛的应用.“共沉淀法”是制备四氧化三铁纳米颗粒的常见方法,具体步骤为:将一定量的FeCl2•4H2O和FeCl3•6H2O制成混合溶液加入到烧瓶中,在N2气氛下,滴加氨水、搅拌、水浴恒温至混合液由橙红色逐渐变成黑色,继续搅拌15min,磁铁分离磁性颗粒,用蒸馏水洗去表面残留的电解质,60℃真空干燥并研磨,可得直径约10nm Fe3O4磁性颗粒. (1)、“共沉淀法”中N2的作用是 , 制备的总离子反应方程式为 .(2)、在医药领域,四氧化三铁纳米颗粒经表面活性剂修饰后,被成功制成磁性液体,又称磁流体(见图a).磁流体属于分散系,负载药物后通过静脉注射或动脉注射进入人体,利用四氧化三铁具有功能,在外界磁场的作用下,富集于肿瘤部位,当外磁场交变时,可控释药.
(1)、“共沉淀法”中N2的作用是 , 制备的总离子反应方程式为 .(2)、在医药领域,四氧化三铁纳米颗粒经表面活性剂修饰后,被成功制成磁性液体,又称磁流体(见图a).磁流体属于分散系,负载药物后通过静脉注射或动脉注射进入人体,利用四氧化三铁具有功能,在外界磁场的作用下,富集于肿瘤部位,当外磁场交变时,可控释药.