高中化学鲁科版(2019)选择性必修2 第3章第2节 几种简单的晶体结构模型
试卷更新日期:2021-06-08 类型:复习试卷
一、单选题
-
1. 关于氯化钠晶体,下列说法正确的是( )A、硬度大于金刚石 B、熔点高于冰 C、沸点大于石墨 D、能导电2. 下列说法错误的是( )A、HClO、N2和 Na2O等物质中,各原子或离子的最外层均达到了稳定结构 B、石英和金刚石都是原子间通过共价键结合形成的原子晶体 C、某化合物在熔融状态下能导电,则一定是离子化合物 D、HF 的热稳定性比 HBr 强是因为 HF 的分子间作用力强3. 磷锡青铜合金广泛用于仪器仪表中的耐磨零件和抗磁元件等。其晶胞结构如图所示。下列说法错误的( )
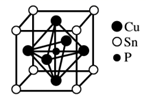 A、磷锡青铜的化学式为Cu3SnP B、该晶胞中与Sn原子等距离且最近的铜原子有12个 C、该晶体的熔点比金刚砂(SiC)的熔点高 D、磷锡青铜具有各向异性的特点4. 下列有关金刚石晶体和二氧化硅晶体(如图所示)的叙述正确的是( )
A、磷锡青铜的化学式为Cu3SnP B、该晶胞中与Sn原子等距离且最近的铜原子有12个 C、该晶体的熔点比金刚砂(SiC)的熔点高 D、磷锡青铜具有各向异性的特点4. 下列有关金刚石晶体和二氧化硅晶体(如图所示)的叙述正确的是( )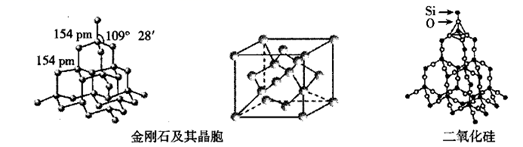 A、金刚石晶体和二氧化硅晶体均属于原子晶体 B、金刚石晶胞中含有6个碳原子 C、 晶体中所含共价键数目为 ( 是阿伏加德罗常数的值) D、金刚石晶体熔化时破坏共价键,二氧化硅晶体熔化时破坏分子间作用力5. 下列说法正确的是( )A、NaHSO4晶体溶于水时,离子键被破坏,共价键不受影响 B、PCl5和CCl4中,每个原子的最外层都具有8电子稳定结构 C、根据氮化铝(AlN)熔沸点很高、熔融状态下不导电可推测它是原子晶体 D、干冰和石英晶体中的化学键类型相同,熔化时需克服微粒间的作用力类型也相同6. 下列说法错误的是( )A、活泼金属与活泼非金属组成的化合物形成的晶体一定为离子晶体 B、金刚石、SiC、HI、HBr晶体的熔点依次降低 C、可用X射线衍射实验区分晶体与非晶体 D、石墨晶体模型中C原子与六元环的个数比为2:17. 下列有关晶体的叙述正确且有因果关系的是( )
A、金刚石晶体和二氧化硅晶体均属于原子晶体 B、金刚石晶胞中含有6个碳原子 C、 晶体中所含共价键数目为 ( 是阿伏加德罗常数的值) D、金刚石晶体熔化时破坏共价键,二氧化硅晶体熔化时破坏分子间作用力5. 下列说法正确的是( )A、NaHSO4晶体溶于水时,离子键被破坏,共价键不受影响 B、PCl5和CCl4中,每个原子的最外层都具有8电子稳定结构 C、根据氮化铝(AlN)熔沸点很高、熔融状态下不导电可推测它是原子晶体 D、干冰和石英晶体中的化学键类型相同,熔化时需克服微粒间的作用力类型也相同6. 下列说法错误的是( )A、活泼金属与活泼非金属组成的化合物形成的晶体一定为离子晶体 B、金刚石、SiC、HI、HBr晶体的熔点依次降低 C、可用X射线衍射实验区分晶体与非晶体 D、石墨晶体模型中C原子与六元环的个数比为2:17. 下列有关晶体的叙述正确且有因果关系的是( )叙述Ⅰ
叙述Ⅱ
A
SiO2晶体熔点高、硬度大
SiO2晶体可用于制造光导纤维
B
碘晶体中的I―I键能较小
晶体碘沸点低、易升华
C
NaCl晶体中Na+与Cl-个数比为1:1,
CsCl晶体中Cs+与Cl-个数比也为1:1
NaCl和CsCl的晶胞结构相同
D
在金刚石和硅晶体中,原子间通过共价键形成空间网状结构
金刚石和硅晶体类型相同
A、A B、B C、C D、D8. 下列说法正确的是( )A、由于铵盐是由离子键构成的,因而化学性质相当稳定 B、分子晶体中都存在分子间作用力,但可能不存在共价键 C、在常见的四种晶体类型中,都有“原子(离子)半径越大,物质熔点越低”的规律 D、水晶在不同方向上的硬度、导热性、导电性相同9. 在一定条件下可制得硬度、熔点都很高的氮化铝晶体,其晶体结构如图所示。下列说法错误的( )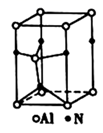 A、1个氮化铝晶胞中含有2个铝原子 B、氮化铝可用于制造切割金属的刀具 C、氮化铝属于离子晶体 D、氮化铝晶体中 的配位数为410. 下列各组物质晶体类型相同的是( )A、SO2和SiO2 B、CCl4和KCl C、干冰和冰 D、晶体Si和单质Na11. 如图是从NaCl和CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( )
A、1个氮化铝晶胞中含有2个铝原子 B、氮化铝可用于制造切割金属的刀具 C、氮化铝属于离子晶体 D、氮化铝晶体中 的配位数为410. 下列各组物质晶体类型相同的是( )A、SO2和SiO2 B、CCl4和KCl C、干冰和冰 D、晶体Si和单质Na11. 如图是从NaCl和CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( )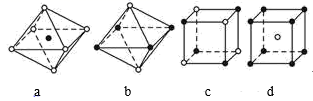 A、只有c B、b和c C、a和c D、a和d
A、只有c B、b和c C、a和c D、a和d二、综合题
-
12. 现有几组物质的熔点(℃)数据:
A组
B组
C组
D组
金刚石:3550 ℃
Li:181 ℃
HF:-83 ℃
NaCl:801 ℃
硅晶体:1410 ℃
Na:98 ℃
HCl:-115 ℃
KCl:776 ℃
硼晶体:2300 ℃
K:64 ℃
HBr:-89 ℃
RbCl:718 ℃
二氧化硅:1723 ℃
Rb:39 ℃
HI:-51 ℃
CsCl:645 ℃
据此回答下列问题:
(1)、A组属于晶体。(2)、B组晶体共同的物理性质是(填序号)。①有金属光泽 ②导电性 ③导热性 ④延展性
(3)、C组中HF熔点反常是由于。(4)、D组晶体可能具有的性质是(填序号)。①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)、D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为。13. 氧化物种类繁多,在生产生活中有广泛应用。按要求回答下列问题。(1)、三种氧化物的熔沸点如下表所示:物质
熔点/℃
沸点/℃
As2O3
175
457.2(193℃时升华)
MgO
2800
3600
Na2O
1275
1950
三种物质中,MgO熔点最高的原因是 。
(2)、Ag2O晶体的立方晶胞如图Ⅰ所示,该晶胞中表示O2−的是(填“A”或“B”),由B构成的空间构型为。其晶胞的俯视图如图Ⅱ所示,其中A的坐标参数为(0,0,1),则B的坐标参数为 。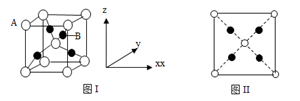 (3)、某种氧化镍晶体中存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,结果其晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。该氧化镍样品的组成可表示为NixO,晶体中Ni3+与Ni2+的个数比为1:11,则x的值为。
(3)、某种氧化镍晶体中存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,结果其晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。该氧化镍样品的组成可表示为NixO,晶体中Ni3+与Ni2+的个数比为1:11,则x的值为。 (4)、某氧化物超导材料钙钛矿晶胞结构如图所示,该化合物的化学式为 , 已知正方体的边长为a pm,该晶体的密度为ρ g·cm-3 , 则阿伏加德罗常数的值可表示为(用含a、ρ的式子表示)。
(4)、某氧化物超导材料钙钛矿晶胞结构如图所示,该化合物的化学式为 , 已知正方体的边长为a pm,该晶体的密度为ρ g·cm-3 , 则阿伏加德罗常数的值可表示为(用含a、ρ的式子表示)。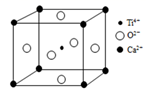 14. (现有几组物质的熔点(℃)数据:
14. (现有几组物质的熔点(℃)数据:A组
B组
C组
金刚石:3550
:
硅晶体:1410
:
硼晶体:2300
:
二氧化硅:1732
:
:2800℃
据此回答下列问题:
(1)、由表格可知,A组熔点普遍偏高,据此回答:①A组属于晶体,其熔化时克服的粒子间的作用力是;
②硼晶体的硬度硅晶体的硬度(填“大于”“小于”)。
(2)、B组中 熔点反常是由于。(3)、C组晶体中 、 、 的熔点由高到低的顺序为 , 晶体的熔点高于三者,其原因是。(4)、氢化铝钠 是一种新型轻质储氢材料,掺入少量 的 在150℃时释氢,在170℃、 条件下又重复吸氢。 的晶胞结构如图所示: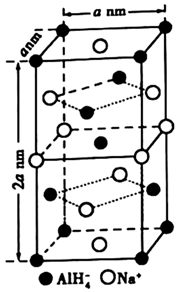
晶体中,与 紧邻且等距的 有个; 晶体的密度为 (用含a的代数式表示)。若 晶胞底心处的 被 取代,得到的晶体为(填化学式)。
15. 下图为几种晶体或晶胞的示意图: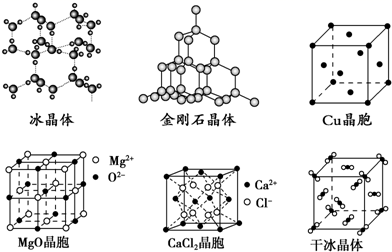
请回答下列问题:
(1)、上述晶体中,粒子之间以共价键结合形成的晶体是。(2)、冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为。(3)、NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能(填“大于”或“小于”)MgO晶体,原因是。(4)、每个Cu晶胞中实际占有个Cu原子,CaCl2晶体中Ca2+的配位数为。(5)、冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是。(6)、MgO晶胞密度为d g/cm3 , 则MgO晶胞的边长为。