初中化学人教版九年级下册第十一单元课题1 生活中常见的盐
试卷更新日期:2021-06-08 类型:同步测试
一、单选题
-
1. 有关复分解反应的说法,一定正确的是( )A、反应物均为化合物 B、产生沉淀 C、元素存在形态改变 D、生成盐和水
-
2. 下列鉴别或区分物质的方法错误的是( )A、用肥皂水鉴别硬水和软水 B、用紫色石蕊溶液区分一氧化碳和二氧化碳 C、用白醋鉴别贝壳粉和面粉 D、通过观察颜色区分二氧化锰和氧化铜
-
3. 下列四个图像中,能正确反映对应变化关系的是( )A、
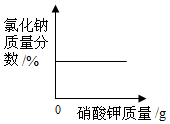 向氯化钠饱和溶液中加入硝酸钾
B、
向氯化钠饱和溶液中加入硝酸钾
B、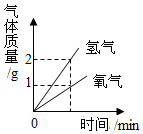 用CuFe2O4-x作催化剂,光分解水制氢气与氧气
C、
用CuFe2O4-x作催化剂,光分解水制氢气与氧气
C、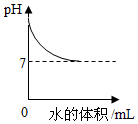 向稀硫酸中加入水
D、
向稀硫酸中加入水
D、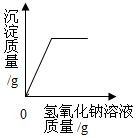 向一定质量的硫酸铜溶液中加氢氧化钠溶液
向一定质量的硫酸铜溶液中加氢氧化钠溶液
-
4. 某化学兴趣小组对A、B、C、D四种未知溶液的成分进行了检验,检验结果见下表。其中检验结果错误的是( )
组别
溶液中检验出的离子
A
K+、Na+、OH-、
B
Ba2+、Na+、Cl-、OH-
C
Cu2+、Mg2+、 、Cl-
D
H+、 、 、
A、A B、B C、C D、D -
5. 下列各组离子在溶液中能大量共存的是( )A、K+、 、 、OH- B、H+、Ba2+、Cl-、OH- C、Fe3+、Na+、 、 D、Ag+、Na+、Cl-、
-
6. 下列物质的鉴别和除杂方案正确的是( )
选项
实验目的
实验方案
A
鉴别 CH4和 H2
点燃后分别在火焰上方罩一个冷而干燥的烧杯
B
鉴别羊毛和涤纶
分别取样,灼烧,闻气味
C
除去 KNO3溶液中的 KCl
加入过量 AgNO3溶液,过滤
D
除去铁粉中的少量铜粉
加入足量稀盐酸,充分反应后过滤、洗涤、干燥
A、A B、B C、C D、D -
7. 如图是初中化学中常见物质间的转化关系,其中A、B、C、D为氧化物,C是使地球产生温室效应的一种气体,丙是一种紫红色金属。(图中部分生成物已略去)下列叙述错误的是( )
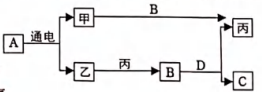 A、A的化学式是H2O B、甲生成丙的化学反应类型为置换反应 C、A与C反应的化学方程式为:CO2+H2O=H2CO3 D、在A生成甲和乙的化学反应中,所得甲乙两种气体的质量比是2:1
A、A的化学式是H2O B、甲生成丙的化学反应类型为置换反应 C、A与C反应的化学方程式为:CO2+H2O=H2CO3 D、在A生成甲和乙的化学反应中,所得甲乙两种气体的质量比是2:1 -
8. 已知①中盛有一定量的Na2CO3溶液,根据图示的实验过程,下列说法错误的是( )
 A、烧杯②中溶液呈红色 B、若步骤b中恰好完全反应,则静置后③中上层清液仍为红色 C、取上述静置后③中上层清液加入过量稀盐酸,无气泡生成 D、烧杯④中大量存在的离子有:Na+、 Ca2+ . 、H+、Cl2、
A、烧杯②中溶液呈红色 B、若步骤b中恰好完全反应,则静置后③中上层清液仍为红色 C、取上述静置后③中上层清液加入过量稀盐酸,无气泡生成 D、烧杯④中大量存在的离子有:Na+、 Ca2+ . 、H+、Cl2、 -
9. 能鉴别盐酸、氢氧化钠溶液、蒸馏水三种无色溶液的试剂是( )A、石蕊溶液 B、BaCl2溶液 C、澄清石灰水 D、生石灰
-
10. 从海水中得到的粗盐中往往含有可溶性杂质(主要有Na2SO4、MgCl2、CaCl2)和不溶性杂质(泥沙等),必须进行分离和提纯后才能使用。粗盐提纯的部分流程如图。有关该流程说法错误的是( )
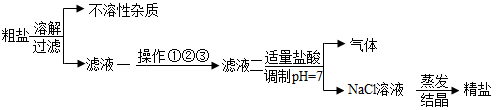 A、不溶性杂质主要是泥沙 B、过滤时玻璃棒的作用是搅拌,以便加快过滤速度 C、蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干 D、操作①②③依次加入的试剂可以为BaCl2溶液、NaOH溶液、Na2CO3溶液
A、不溶性杂质主要是泥沙 B、过滤时玻璃棒的作用是搅拌,以便加快过滤速度 C、蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干 D、操作①②③依次加入的试剂可以为BaCl2溶液、NaOH溶液、Na2CO3溶液
二、填空题
-
11. 某白色固体A可能含有碳酸钠、氧化钙、氯化钠中的一种或几种,进行如下实验:
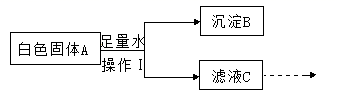
完成下列问题:
①操作I的名称是。根据上述实验流程分析,A中一定含有的物质是(填化学式),A中加足量的水后发生反应的化学方程式 , 。
②为进一步确定固体A中可能存在的物质,对滤液C进行实验,完成下表。
实验操作
现象
结论
用一支洁净的试管取适量滤液C,。
A中有氯化钠
-
12. 下列各组物质:①Na2CO3溶液和盐酸 ②稀盐酸和KOH溶液 ③NaOH溶液和KCl溶液④硫酸铜溶液和氯化钡溶液,能发生复分解反应的是(填序号),其中盐和盐反应的化学方程式是。
-
13. A〜E是初中常见的五种物质,它们有如图所示的转化关系。已知A、C是无色液体,B、F是无色气体,其中D、G是黑色固体,E在纯净的B中燃烧火星四射。B转化为G的反应的文字表达式为 , 该反应属于反应(填基本反应类型)。
三、综合题
-
14. 我国制碱工业先驱侯德榜发明了“侯氏制碱法”。其模拟流程如下:
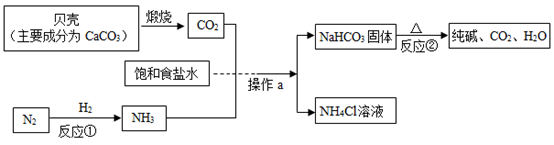 (1)、操作a的名称是。(2)、NH3中氮元素的化合价为。(3)、反应②的基本反应类型为。(4)、反应①的微观示意图如下,请在方框中补全相应微粒的图示。
(1)、操作a的名称是。(2)、NH3中氮元素的化合价为。(3)、反应②的基本反应类型为。(4)、反应①的微观示意图如下,请在方框中补全相应微粒的图示。
-
15. 我市拥有丰富的海洋资源,综合利用这些宝贵的资源有力地促进了经济的发展。通过晾晒海水,可以得到粗盐,粗盐中含有不溶性杂质(如泥沙等)和可溶性杂质(如MgCl2、CaCl2等),工业上以粗盐为原料制取精盐,其生产流程如图所示。

请回答下列问题:
(1)、如图中操作b中玻璃棒的作用是。在加热蒸发过程中,当蒸发皿中时,停止加热。粗盐中除去泥沙后的澄清滤液中还含有MgCl2、CaCl2 , 要想知道该滤液是硬水还是软水,可加入进行检验。(2)、如图中加入Na2CO3溶液除去的离子是(填离子符号),加入NaOH溶液发生反应的化学方程式为;加入足量稀盐酸的目的是。如果称量I中称得粗盐的质量为3g,称量Ⅱ中称得精盐的质量为3.1g,则下列分析正确的是(填字母)A 粗盐没有完全溶解 B 除杂过程中有NaCl生成
C 蒸发时水分没有蒸干 D 称量精盐时药品和砝码的位置放反了,且使用了游码
(3)、小明用所得精盐配制一定溶质质量分数的氯化钠溶液的过程如图所示: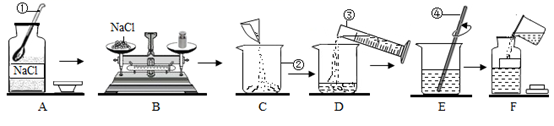
①操作A中的不正确是。
②配制10g质量分数为15%的氯化钠溶液,所需氯化钠的质量为g。
③对配制的溶液进行检测时发现溶质质量分数偏小,其原因可能有(填字母)。
A 称量氯化钠时只在药品端垫纸片 B 量取水的体积时,仰视读数
C烧杯事先用水润洗过,内壁有水残留 D装瓶时,有少量溶液洒出
④把10g质量分数为15%的氯化钠溶液稀释成质量分数为5%的氯化钠溶液,需要水的质量是g,该实验的操作步骤为:计算、、混匀等。
四、推断题
-
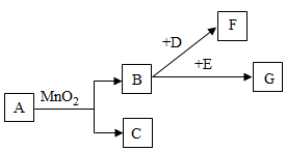
16. 已知A是固体碱式碳酸铜,其化学式是Cu2(OH)2CO3 , 它受热可分解为三种氧化物,物质转化关系如图所示。其中C、F、H、I是无色气体,B通电时,在阴极产生I,在阳极产生H。根据推断回答下列问题:
 (1)、铜锈的主要成分是碱式碳酸铜。铜生锈与空气中氧气和水有关,还与空气中的(填化学式)有关。(2)、D物质的化学式是。(3)、反应②的化学方程式。(4)、反应⑤的化学方程式。
(1)、铜锈的主要成分是碱式碳酸铜。铜生锈与空气中氧气和水有关,还与空气中的(填化学式)有关。(2)、D物质的化学式是。(3)、反应②的化学方程式。(4)、反应⑤的化学方程式。 -
17. 下图是初中化学常见物质间的反应和转化关系。A是常见的溶剂,C、F属于同类物质,D是一种钠盐。图中的“一”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。
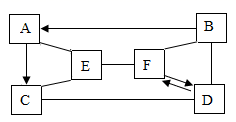 (1)、写出物质C的化学式。(2)、若B由三种元素组成,则其化学式为。(3)、D→F反应的化学方程式为。(4)、A与E反应的化学方程式为。
(1)、写出物质C的化学式。(2)、若B由三种元素组成,则其化学式为。(3)、D→F反应的化学方程式为。(4)、A与E反应的化学方程式为。
五、计算题
-
18. 取硫酸铜和硫酸钠混合物8.9g,向其中加入100g溶质质量分数为4%的氢氧化钠溶液,恰好完全反应。计算:(1)、样品中硫酸铜的质量;(2)、反应中生成的沉淀的质量;(3)、反应后溶液中溶质的质量分数(计算结果精确至0.1%)。
