山西省怀仁市2020-2021学年高一下学期化学期中考试试卷
试卷更新日期:2021-06-07 类型:期中考试
一、单选题
-
1. 类比是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观实际。下列各说法中正确的是( )A、铁和氯气加热生成 ,则铁和硫单质加热生成 B、 通入 溶液中不产生沉淀,则 通入 溶液中也不产生沉淀 C、铝与稀硫酸反应生成氢气,则铝与稀硝酸反应也生成氢气 D、 可以治疗胃酸过多,则NaOH也可以治疗胃酸过多2. 下列说法正确的是( )A、 可与 完全反应生成 B、 即可作氧化剂又可作还原剂 C、二氧化硫具有漂白性,能使品红溶液和紫色石蕊试液褪色 D、陶瓷餐具、混凝土桥墩、水晶镜片都使用了硅酸盐材料3. 工业生产中为了盛放大量浓硝酸,下列可选择作为罐体材料的是( )A、Pt B、Cu C、Mg D、Al4. 对下列事实的解释错误的是( )A、高纯硅可制成计算机芯片,是利用其半导体性能 B、浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 C、在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有氧化性 D、反应 能进行,说明CuS既不溶于水也不溶于稀5. 为分析矿物X中的常见离子,将其溶于稀盐酸,将所得溶液进行实验,下列依据实验现象得出的结论正确的是( )A、用铂丝蘸取少量溶液进行焰色试验,火焰呈黄色,说明矿物X中不含K+ B、取少量溶液向其中滴加AgNO3溶液,出现白色沉淀,说明矿物X中含Cl- C、取少量溶液向其中滴加Ba(NO3)2溶液,有白色沉淀产生,说明矿物X中含 D、取少量溶液向其中滴加过量NaOH溶液,加热,用湿润红色石蕊试纸检验生成的气体,试纸变蓝,说明矿物X中含6. 下列关于氮及其化合物的说法错误的是( )A、“氨溶于水的喷泉实验”装置图,烧杯中换成其它液体无法形成喷泉 B、雷电固氮是自然界中氮的固定途径之一 C、在 与水的反应中,氧化剂和还原剂的质量之比是1∶2 D、氨的催化氧化是工业制硝酸的基础7. 下列反应产生的气体,通入 溶液不反应的是( )A、 和浓盐酸 B、Al与NaOH溶液 C、浓硝酸和铜片 D、铜片和浓硫酸共热8. 目前国际空间站处理 废气涉及的反应为 。下列关于该反应的说法错误的是( )A、升高温度能加快该反应的速率 B、钌催化剂能加快该反应的速率 C、达到平衡时,v(正)=v(逆)=0 D、一定条件下,当 转化率达到最大值时,反应达到平衡9. 几位同学以相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:
实验编号
水果种类
电极间距离/cm
电流
1
番茄
1
98.7
2
番茄
2
72.5
3
苹果
2
27.2
下列关于水果电池的说法错误的是( )
A、负极都是锌片 B、能表明水果种类对电流大小影响的实验编号是2和3 C、影响水果电池电流大小的因素可能还有同种水果的成熟程度 D、该实验的目的只是探究水果种类对水果电池电流大小的影响10. 下列叙述错误的是( )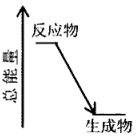 A、化学反应中能量变化的大小与反应物的质量多少有关 B、盐酸和碳酸氢钠的反应过程中能量关系可用如图表示 C、节能的主要环节一是燃料的燃烧阶段,二是能量利用阶段 D、节能不是简单地减少能源的使用,更重要的是要充分有效地利用能源11. 下列离子方程式错误的是( )A、三氧化硫与氯化钡溶液生成沉淀的反应: B、用NaOH溶液吸收少量H2S: C、在 溶液中滴加NaOH溶液至过量,整个过程总反应的离子方程式为: D、过量铁粉与稀硫酸和硝酸钾混合溶液反应:12. 我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应: ,在低温下获得高转化率与高反应速率。反应过程示意图如下:
A、化学反应中能量变化的大小与反应物的质量多少有关 B、盐酸和碳酸氢钠的反应过程中能量关系可用如图表示 C、节能的主要环节一是燃料的燃烧阶段,二是能量利用阶段 D、节能不是简单地减少能源的使用,更重要的是要充分有效地利用能源11. 下列离子方程式错误的是( )A、三氧化硫与氯化钡溶液生成沉淀的反应: B、用NaOH溶液吸收少量H2S: C、在 溶液中滴加NaOH溶液至过量,整个过程总反应的离子方程式为: D、过量铁粉与稀硫酸和硝酸钾混合溶液反应:12. 我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应: ,在低温下获得高转化率与高反应速率。反应过程示意图如下: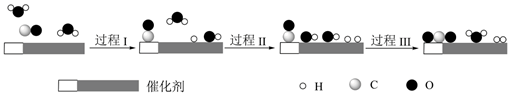
下列说法正确的是( )
A、过程Ⅰ、过程Ⅱ均为放热过程 B、该催化过程中:有极性键和非极性键的断裂,也有极性键和非极性键的形成 C、图示显示:起始时的2个 在反应过程中并未都参与了反应 D、一定条件下,当CO和 反应未达到限度时,13. 下列叙述错误的是( )A、原电池的必要组成部分有电极材料、还原剂和氧化剂、闭合回路 B、常见的锌锰干电池属于一次电池,手机用锂离子电池属二次电池 C、冷敷袋盛装的主要物质是冰或硝酸铵+水合碳酸钠,都是利用了吸热的化学变化 D、化学能和其它形式的能相互转化的途径是化学反应14. 如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )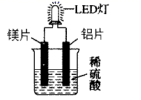 A、电流从镁片经导线流向铝片 B、若将镁片换成铜片,铝电极的作用不相同 C、若将稀硫酸换成NaOH溶液,LED灯将不会发光 D、若将稀硫酸换成NaOH溶液,LED灯仍会发光且电池的总反应式相同15. 凭借清洁、储量大、能量转换率高、运行稳定等优势,氢能被现代工业视为最理想、潜力最大的新能源。氢燃料电池被誉为氢能源汽车的心脏。某种氢燃料电池的内部结构如图,下列说法正确的是(设 为阿伏加德常数值)( )
A、电流从镁片经导线流向铝片 B、若将镁片换成铜片,铝电极的作用不相同 C、若将稀硫酸换成NaOH溶液,LED灯将不会发光 D、若将稀硫酸换成NaOH溶液,LED灯仍会发光且电池的总反应式相同15. 凭借清洁、储量大、能量转换率高、运行稳定等优势,氢能被现代工业视为最理想、潜力最大的新能源。氢燃料电池被誉为氢能源汽车的心脏。某种氢燃料电池的内部结构如图,下列说法正确的是(设 为阿伏加德常数值)( ) A、电池每消耗11.2L氢气,电路中通过的电子数目为 B、a处通入的是氧气 C、右侧电极发生的反应为: D、电池的总反应式是:16. 将5.6g铁粉投入盛有 稀硫酸的烧杯中,4min时铁粉刚好溶解完全。若反应前后溶液的体积不变,则0~4min内,该反应的平均速率可表示为( )A、 B、 C、 D、17. 向体积均为2L的A、B、C三个密闭容器中分别充入1molX气体和3molY气体,发生反应: 。2min后反应达到最大限度,测得A中剩余0.4molX,B中用Z表示的反应速率为v(Z)=0.3 mol/(L·min),C中Y的浓度为0.5mol/L。则0~2min内三个容器中反应速率的大小关系为( )A、B>A>C B、C>A=B C、B>A=C D、A>B>C18. 某课外实验小组利用压强传感器、数据采集器和计算机等数字化实验设备,探究镁与不同浓度盐酸的反应速率,两组实验所用药品如下:
A、电池每消耗11.2L氢气,电路中通过的电子数目为 B、a处通入的是氧气 C、右侧电极发生的反应为: D、电池的总反应式是:16. 将5.6g铁粉投入盛有 稀硫酸的烧杯中,4min时铁粉刚好溶解完全。若反应前后溶液的体积不变,则0~4min内,该反应的平均速率可表示为( )A、 B、 C、 D、17. 向体积均为2L的A、B、C三个密闭容器中分别充入1molX气体和3molY气体,发生反应: 。2min后反应达到最大限度,测得A中剩余0.4molX,B中用Z表示的反应速率为v(Z)=0.3 mol/(L·min),C中Y的浓度为0.5mol/L。则0~2min内三个容器中反应速率的大小关系为( )A、B>A>C B、C>A=B C、B>A=C D、A>B>C18. 某课外实验小组利用压强传感器、数据采集器和计算机等数字化实验设备,探究镁与不同浓度盐酸的反应速率,两组实验所用药品如下: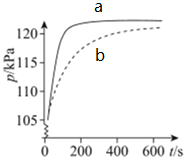
序号
镁条的质量/g
盐酸
物质的量浓度
体积/mL
1
0.01
1.0
2
2
0.01
0.5
2
实验结果如图所示:下列叙述错误的是( )
A、该探究实验采用了变量控制的研究方法 B、曲线斜率可表征反应速率 C、理论上若时间足够长,最终反应生成的气体的量应该相同 D、曲线b表示 盐酸与镁的反应19. 由粗 制备纯的 流程如图所示,下列说法错误的是( )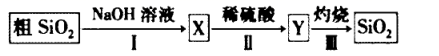 A、X具有黏结力强、耐高温等特性,可用作黏合剂和防火剂 B、步骤Ⅱ的反应是 C、步骤Ⅱ中的稀硫酸可用 替代 D、若在实验室中完成步骤Ⅲ,一般在蒸发皿中进行20. 能实现下列物质间直接转化的元素是( )
A、X具有黏结力强、耐高温等特性,可用作黏合剂和防火剂 B、步骤Ⅱ的反应是 C、步骤Ⅱ中的稀硫酸可用 替代 D、若在实验室中完成步骤Ⅲ,一般在蒸发皿中进行20. 能实现下列物质间直接转化的元素是( )单质 氧化物 酸(或碱) 盐
A、N B、Si C、S D、Fe21. 以下有关碳纳米管、富勒烯、石墨烯的说法错误的是( )A、它们的物理性质相同 B、它们都是新型无机非金属材料中的碳纳米材料 C、它们都是碳单质 D、它们分别完全燃烧后生成物相同22. 日常生活中的下列做法,与调控反应速率有关的是( )①向门窗合页里注油; ②食品抽真空包装;
③用冰箱冷藏食物; ④在糕点包装袋内放置活性铁粉作抗氧化剂
A、①②③④ B、①③④ C、②③④ D、①③23. 生产液晶显示器过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000-20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:化学键
键能
941.7
154.8
283.0
下列说法中正确的是( )
A、反应中 为吸热反应 B、过程 放出能量 C、反应中 ,N2与F2的总能量小于NF3的总能量 D、NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应24. 一定温度和压强下,在2L的密闭容器中合成氨 。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。下列说法错误的是( )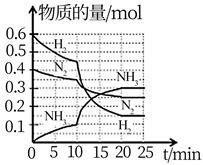 A、0~10min内,以 表示的平均反应速率为 B、10~20min内, 浓度变化的原因可能是缩小容器容积 C、 的平衡转化率与 平衡转化率相等 D、该反应在20min时达到化学平衡状态
A、0~10min内,以 表示的平均反应速率为 B、10~20min内, 浓度变化的原因可能是缩小容器容积 C、 的平衡转化率与 平衡转化率相等 D、该反应在20min时达到化学平衡状态二、综合题
-
25. 请回答下列问题:(1)、现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。
 制取氨气时烧瓶中的X固体常用(写一种)。关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧瓶口c,打开b,完成喷泉实验。电脑绘制三颈瓶内压强变化曲线如图2,则点时喷泉最剧烈,理由是。(2)、用消石灰和氯化铵固体制备NH3
制取氨气时烧瓶中的X固体常用(写一种)。关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧瓶口c,打开b,完成喷泉实验。电脑绘制三颈瓶内压强变化曲线如图2,则点时喷泉最剧烈,理由是。(2)、用消石灰和氯化铵固体制备NH3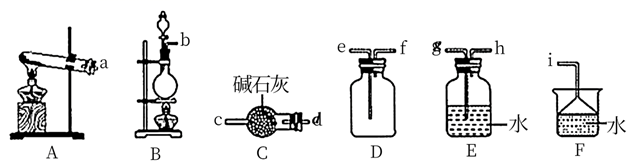 NH3的发生装置应选择上图中的(填大写字母代号),制备NH3的化学方程式为;欲收集一瓶干燥的NH3 , 选择上图的装置,其连接顺序为:发生装置→。(按气流方向,用小写字母表示)。(3)、设计了下图所示的实验装置模拟工业生产制备少量硝酸。
NH3的发生装置应选择上图中的(填大写字母代号),制备NH3的化学方程式为;欲收集一瓶干燥的NH3 , 选择上图的装置,其连接顺序为:发生装置→。(按气流方向,用小写字母表示)。(3)、设计了下图所示的实验装置模拟工业生产制备少量硝酸。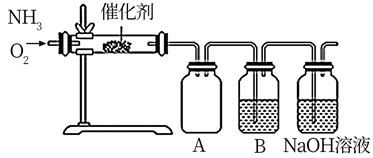
①实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是(填“吸热”或“放热”)反应,B中试剂为 , NaOH溶液的作用是;
②控制氨气和氧气的比例是制备硝酸的关键。
当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。白烟的化学式是;欲使氨气尽可能完全转化为硝酸,理论上 的最佳比例为。
26. 我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。某校探究学习小组同学用含有少量杂质(主要为少量泥沙、 、 、 等)的粗盐制取较纯净的NaCl,实验前他们设计了如图所示的实验方案。
请回答:
(1)、请写出操作第④、⑤步所加试剂名称:④;⑤。(2)、写出第⑤步操作中可能发生反应的离子方程式:;。(3)、第⑥步需要用到的主要仪器有:带铁圈的铁架台、酒精灯、和。(4)、你认为该设计里哪些步骤调换后不影响实验结果:;(5)、有同学认为上述实验设计步骤可以简化,请你提出简化的一种设想:。27. 非金属及其化合物是一类重要的化工原料。回答下列问题:(1)、向21.6g铁粉和铜粉的混合物中加入1L1mol/L硝酸溶液,充分反应,放出NO气体且金属有剩余。则反应后溶液中 可能为。(2)、某化学兴趣小组为了探究 、 同时通入 中发生的反应,设计了如图所示的实验装置。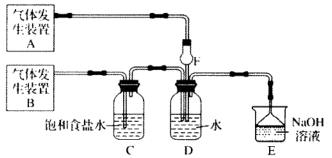
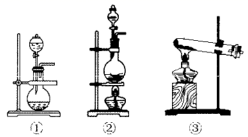
该化学兴趣小组的同学为制取 、 气体,现采用 与70%的硫酸为原料制取 ,采用 和浓盐酸(12mol/L)为原料制取 。发生装置A应选择以下三种装置中的(填序号)。装置A中发生反应的化学方程式为。D装置中主要反应的离子方程式为。
 (3)、 和 具有相似的化学性质,能使酸性 溶液褪色,反应的离子方程式为。 也能使酸性 溶液褪色且溶液仍澄清,反应的离子方程式为。(4)、 用于工业制硫酸时,涉及反应的化学方程式是。28. 氮化硅是一种性能优异的无机非金属材料,它的熔点高,硬度大,电绝缘性好,化学性质稳定,但生产成本较高。不溶于酸(氢氟酸除外)。高温下氧气及水蒸气能明显腐蚀氮化硅。一种用工业硅(含少量铁、铜的单质及氧化物)和 (含少量 )合成氮化硅的工艺流程如下:
(3)、 和 具有相似的化学性质,能使酸性 溶液褪色,反应的离子方程式为。 也能使酸性 溶液褪色且溶液仍澄清,反应的离子方程式为。(4)、 用于工业制硫酸时,涉及反应的化学方程式是。28. 氮化硅是一种性能优异的无机非金属材料,它的熔点高,硬度大,电绝缘性好,化学性质稳定,但生产成本较高。不溶于酸(氢氟酸除外)。高温下氧气及水蒸气能明显腐蚀氮化硅。一种用工业硅(含少量铁、铜的单质及氧化物)和 (含少量 )合成氮化硅的工艺流程如下: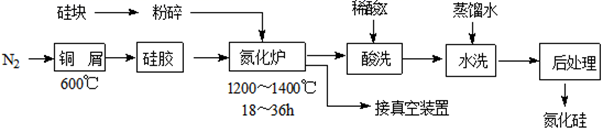 (1)、 净化时,铜屑的作用是;将硅块粉碎的作用是。(2)、在氮化炉中每生成 转移电子的物质的量是。(3)、X可能是(选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。(4)、如何说明氮化硅产品已用水洗干净?。(5)、推测氮化硅可能有哪些用途:(填字母)。
(1)、 净化时,铜屑的作用是;将硅块粉碎的作用是。(2)、在氮化炉中每生成 转移电子的物质的量是。(3)、X可能是(选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。(4)、如何说明氮化硅产品已用水洗干净?。(5)、推测氮化硅可能有哪些用途:(填字母)。a.制作切削刀具 b.制作坩埚
c.用作建筑陶瓷 d.制作耐高温轴承
(6)、工业上还可以采用化学气相沉积法,在 的保护下,使 与 在高温下反应生成 沉积在石墨表面,该反应的化学方程式为。