山东省泰安肥城市2020-2021学年高一下学期化学期中考试试卷
试卷更新日期:2021-06-07 类型:期中考试
一、单选题
-
1. 2020年12月,嫦娥五号返回器携带月球土壤样品“月壤”在预定区域安全着陆,标志着我国探月工程取得圆满成功。下列有关说法正确的是( )A、“月壤”中的 He与地球上的 He互为同素异形体 B、 He和 H互为同位素 C、 He原子核外电子数为3 D、居里夫人用 He原子核轰击 Al原子核,得到核素Y: Al+ He→Y+ n,则Y为磷元素2. 截止到2021年4月全球新冠肺炎确诊人数超过1亿,在阻击新冠肺炎的战役中最大程度的体现了我国的政治优势。防疫过程中,其中医用酒精和“84” 消毒液、双氧水等均能起到杀菌作用。下列有关说法错误的是( )A、酒精的分子式:C2H6O B、NaClO的电子式:
 C、HClO的结构式:H—Cl—O
D、H2O2的球棍模型:
C、HClO的结构式:H—Cl—O
D、H2O2的球棍模型:  3. 下列说法正确的是( )A、同一原子中,在离核较远的区域运动的电子能量较高 B、原子核外电子排布,先排满K层再排L层、先排满M层再排N层 C、同一周期中,随着核电荷数的增加,元素的原子半径逐渐增大 D、同一周期中,IIA与IIIA族元素原子的核电荷数都相差14. 下列各组物质中,化学键类型不同的是( )A、SiCl4和CH4 B、NaCl和HNO3 C、H2O和NH3 D、CaF2和CsCl5. 下列颜色的变化中,不是因为发生化学反应而产生的是( )A、乙醇使酸性KMnO4溶液褪色 B、将苯滴入溴水中,振荡后水层接近无色 C、甲烷与氯气混合光照后黄绿色变浅 D、乙烯使溴的四氯化碳溶液褪色6. 海带产量高、价格低,常用作提取碘单质的原料。实验室从海带中提取碘的部分流程如图所示,下列实验装置或操作能达到实验目的的是
3. 下列说法正确的是( )A、同一原子中,在离核较远的区域运动的电子能量较高 B、原子核外电子排布,先排满K层再排L层、先排满M层再排N层 C、同一周期中,随着核电荷数的增加,元素的原子半径逐渐增大 D、同一周期中,IIA与IIIA族元素原子的核电荷数都相差14. 下列各组物质中,化学键类型不同的是( )A、SiCl4和CH4 B、NaCl和HNO3 C、H2O和NH3 D、CaF2和CsCl5. 下列颜色的变化中,不是因为发生化学反应而产生的是( )A、乙醇使酸性KMnO4溶液褪色 B、将苯滴入溴水中,振荡后水层接近无色 C、甲烷与氯气混合光照后黄绿色变浅 D、乙烯使溴的四氯化碳溶液褪色6. 海带产量高、价格低,常用作提取碘单质的原料。实验室从海带中提取碘的部分流程如图所示,下列实验装置或操作能达到实验目的的是

下列说法正确的是( )
A、完成步骤①需要装置III B、完成步骤③需要装置I C、完成步骤⑤需要装置II D、完成步骤②和④需要装置IV7. 下列说法正确的是( )A、离子化合物中一定含有金属元素 B、构成物质的分子中一定含有化学键 C、CO2和PCl3分子中每个原子的最外层都具有8电子稳定结构 D、在Na2O、NaHSO4晶体中,阳离子与阴离子个数比均为2∶18. 下列说法中错误的是( )A、天然气和沼气的主要成分都是甲烷,它是一种清洁能源 B、工业上苯、萘等物质可由煤干馏得到,它们主要存在于煤干馏所得的煤焦油中 C、石油裂化的目的是提高汽油等轻质燃料的产量和质量 D、煤的干馏和石油的分馏都是物理变化9. 下列关于物质性质的比较,错误的是( )A、还原性强弱:F->Cl->Br- B、酸性强弱:HClO4>H2SO4>H3PO4>H2SiO3 C、原子半径大小:K>Na>S>O D、稳定性:HF>H2O>NH310. 阴离子Xn-含中子N个,X的质量数为A,则agX的氢化物中含质子的物质的量是( )A、 (N-a)mol B、 (n+A)mol C、 (N+n)mol D、 (A-N+n)mol11. 由粗SiO2制备纯的SiO2流程如图所示,下列说法错误的是( )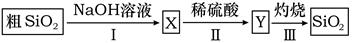 A、SiO2可用于制造光导纤维 B、步骤Ⅱ的反应是Na2SiO3 + H2SO4=H2SiO3↓+Na2SO4 C、步骤Ⅱ中的稀硫酸可用CO2替代 D、若在实验室中完成步骤Ⅲ,一般在蒸发皿中进行12. 下述实验方案能达到实验目的的是( )
A、SiO2可用于制造光导纤维 B、步骤Ⅱ的反应是Na2SiO3 + H2SO4=H2SiO3↓+Na2SO4 C、步骤Ⅱ中的稀硫酸可用CO2替代 D、若在实验室中完成步骤Ⅲ,一般在蒸发皿中进行12. 下述实验方案能达到实验目的的是( )选项
A
B
C
D
方案




目的
收集乙烯并验证它与溴水发生加成反应
在光照条件下制取纯净的一氯甲烷
分馏石油获得汽油
除去甲烷中少量的乙烯
A、A B、B C、C D、D二、多选题
-
13. 已知四种短周期主族元素在周期表中相对位置如图所示。下列说法正确的是( )
①
②
③
④
A、②、④两元素的最高化合价一定相等 B、①、③原子序数差一定等于8 C、③、④的最高价氧化物对应的水化物一定能反应 D、若①的最外层电子数是核外电子层数的3倍,则②的单质一定具有强氧化性14. 维生素A的结构简式如下图所示,关于它的叙述中正确的是( ) A、维生素A属于烃 B、维生素A含有两种官能团 C、维生素A不能使酸性KMnO4溶液褪色 D、维生素A能发生取代、加成、酯化反应15. X、Y、Z、W四种短周期主族元素,原子序数依次增大,X与Z同主族,Y与W同主族;X为短周期元素中原子半径最小的元素,Y原子的最外层电子数为次外层电子数的3倍,下列说法正确的是( )A、Y与其他三种元素可分别形成两种化合物 B、Y与Z形成的化合物只含有离子键 C、简单氢化物的沸点:Y>W D、Z的氧化物对应水化物是强酸
A、维生素A属于烃 B、维生素A含有两种官能团 C、维生素A不能使酸性KMnO4溶液褪色 D、维生素A能发生取代、加成、酯化反应15. X、Y、Z、W四种短周期主族元素,原子序数依次增大,X与Z同主族,Y与W同主族;X为短周期元素中原子半径最小的元素,Y原子的最外层电子数为次外层电子数的3倍,下列说法正确的是( )A、Y与其他三种元素可分别形成两种化合物 B、Y与Z形成的化合物只含有离子键 C、简单氢化物的沸点:Y>W D、Z的氧化物对应水化物是强酸三、填空题
-
16.(1)、下列几组物质中:
①18O2和16O2 ② C和 C ③正丁烷和异丁烷 ④红磷和白磷
⑤
 和
和  ⑥
⑥  和
和 
⑦CH4和

属于同位素的是(填序号,下同);属于同分异构体的是;属于同系物的是。
(2)、下列各物质:①He ②NH3 ③H2O2 ④CaO ⑤KOH ⑥Na2O2 ⑦Al2O3 ⑧MgCl2中,只含共价键的是;既含离子键又含共价键的物质是。(3)、下列变化过程:①碘的升华 ②NaCl固体溶于水 ③蔗糖溶于水 ④HCl气体溶于水⑤烧碱熔化 ⑥氯化铵受热分解,其中化学键没有被破坏的是;既破坏离子键又破坏共价键的是。四、综合题
-
17. X、Y、Z、R、W为常见的主族元素,根据下表信息回答问题:
元素
元素性质或原子结构信息
X
短周期元素原子半径最大(稀有气体元素不参与比较)
Y
+3价阳离子的核外电子排布与氖原子相同
Z
Z 元素的单质为淡黄色固体
R
与Z同周期,主要化合价为−1、+7
W
原子结构示意图:
 (1)、写出元素R的离子结构示意图;元素W在周期表中位置为。(2)、X、Y、Z、R元素形成的四种简单离子半径由大到小顺序为(用离子符号表示)。(3)、R的最高价氧化物对应水化物的化学式为 , 与X的最高价氧化物对应水化物反应的离子方程式为。(4)、用电子式表示X和Z形成化合物的过程:。(5)、下列对于W及其化合物的推断中,正确的是________(填序号)。A、W的最低负化合价与Z的最低负化合价相同 B、W的氢化物的稳定性弱于R的氢化物的稳定性 C、W的最高价氧化物对应水化物的酸性比Z的强 D、W的非金属性介于Z和R之间18. 依据下列有机物分子的示意图填空。
(1)、写出元素R的离子结构示意图;元素W在周期表中位置为。(2)、X、Y、Z、R元素形成的四种简单离子半径由大到小顺序为(用离子符号表示)。(3)、R的最高价氧化物对应水化物的化学式为 , 与X的最高价氧化物对应水化物反应的离子方程式为。(4)、用电子式表示X和Z形成化合物的过程:。(5)、下列对于W及其化合物的推断中,正确的是________(填序号)。A、W的最低负化合价与Z的最低负化合价相同 B、W的氢化物的稳定性弱于R的氢化物的稳定性 C、W的最高价氧化物对应水化物的酸性比Z的强 D、W的非金属性介于Z和R之间18. 依据下列有机物分子的示意图填空。 (1)、A分子的空间构型为 , D的结构简式是。(2)、上述有机物中,所有原子均共平面的是(填有机物的名称)。(3)、相同质量的上述物质在足量氧气中完全燃烧时,消耗氧气物质的量最多的是(填结构简式)。(4)、C分子中不存在碳碳单键与碳碳双键交替的结构,下列实验的结果可以作为证据的是(填序号)。
(1)、A分子的空间构型为 , D的结构简式是。(2)、上述有机物中,所有原子均共平面的是(填有机物的名称)。(3)、相同质量的上述物质在足量氧气中完全燃烧时,消耗氧气物质的量最多的是(填结构简式)。(4)、C分子中不存在碳碳单键与碳碳双键交替的结构,下列实验的结果可以作为证据的是(填序号)。①将C滴入酸性高锰酸钾溶液,振荡,看是否褪色;
②经测定,C分子中碳碳键的键长相等,都是1.40×10−10 m
③C在一定条件下既能发生取代反应,又能发生加成反应
④C的二氯取代产物只有一种结构
(5)、A的同系物E有5个碳原子,其分子式为 , E的一种同分异构体与氯气反应只生成一种一氯代物,写出其结构简式:。19. 乙烯在化工生产领域中应用广泛。(1)、乙烯能合成很多有实用价值的有机物。
①试剂a是;
②反应Ⅰ的反应类型是;
③写出反应II和反应III的化学方程式:;。
(2)、以原油为起始原料合成聚乙烯的路线如图所示。
①聚乙烯的结构简式是;
②写出分子式符合C4H10的有机物的结构简式。
20. 燃烧某气态链烃A生成1.12 L(标准状况)CO2和0.05 mol H2O。该烃的蒸气对氢气的相对密度是21,求该烃的分子式并写出可能的结构简式及名称;;。21. 元素的金属性、非金属性是元素的重要性质。实验室通过简单的“试管实验”即可探索元素的金属性、非金属性的强弱。(1)、请你选用下列试剂,根据实验要求完成下表。试剂:①镁条②铝条③氯水④AlCl3溶液⑤MgCl2溶液⑥NaBr溶液⑦氢硫酸⑧水⑨NaOH溶液
实验方案(只要求填写选用试剂)
实验一
实验二
①(填试剂序号)
②(填试剂序号)
实验现象
一支试管中有白色沉淀,另一支试管中先生成白色沉淀,后白色沉淀消失
③
有关反应的离子方程式
④;
⑤
结论
金属性:Mg>Al
非金属性:⑥
(2)、从原子结构的角度解释金属性Mg大于Al的原因:。
-