山东省青岛胶州市2020-2021学年高一下学期化学期中考试试卷
试卷更新日期:2021-06-07 类型:期中考试
一、单选题
-
1. 化学与生产、生活密切相关。下表中物质在生产、生活中的应用及解释均正确的是( )
选项
应用
解释
A
75%的酒精可用于皮肤消毒
酒精具有强氧化性
B
KIO3应用于制加碘食盐
KIO3可补充人体缺少的碘元素
C
高铁车厢采用铝合金材料
铝化学性质稳定,难与氧气反应
D
高纯硅作计算机芯片的材料
硅晶体在自然界中能稳定存在
A、A B、B C、C D、D2. 下列有关物质性质或概念的叙述错误的是( )A、焰色试验可以判断某种金属元素的存在 B、甲烷燃烧释放能量是因为甲烷键能大 C、太阳能电池的主要材料是高纯硅 D、物质间发生化学反应时,化学键一定发生变化3. 下列有关化学用语错误的是( )A、HCl的电子式: B、N2的结构式:N≡N
C、S2-的结构示意图:
B、N2的结构式:N≡N
C、S2-的结构示意图:  D、质子数为13、中子数为14的铝原子:
4. 实验室海带提碘过程中,下列操作未涉及的是( )A、
D、质子数为13、中子数为14的铝原子:
4. 实验室海带提碘过程中,下列操作未涉及的是( )A、 B、
B、 C、
C、 D、
D、 5. 2020年12月17日,嫦娥五号返回器携带2公斤月壤返回地球。经分析,月壤中吸附大量的 , 是清洁、安全和高效的核聚变发电的燃料,地球上氦元素则主要以 形式存在。下列说法正确的是( )A、 的核外电子数为3 B、 和 互为同位素 C、 发生核聚变时吸收大量能量 D、 化学性质非常活泼6. 利用元素在元素周期表中的“位构性”关系,我们可以预测陌生元素及其化合物的性质。下列有关铝、硅元素及其化合物的叙述正确的是( )A、氢氧化铝既能溶于盐酸又能溶于NaOH溶液 B、二氧化硅属于酸性氧化物,不能与任何酸反应 C、铝属于活泼金属,其化合物中一定存在离子键 D、硅酸是一种弱酸,可由二氧化硅与水化合制得7. 某同学运用元素周期表和周期律相关知识,推测铍及其化合物的性质:( )
5. 2020年12月17日,嫦娥五号返回器携带2公斤月壤返回地球。经分析,月壤中吸附大量的 , 是清洁、安全和高效的核聚变发电的燃料,地球上氦元素则主要以 形式存在。下列说法正确的是( )A、 的核外电子数为3 B、 和 互为同位素 C、 发生核聚变时吸收大量能量 D、 化学性质非常活泼6. 利用元素在元素周期表中的“位构性”关系,我们可以预测陌生元素及其化合物的性质。下列有关铝、硅元素及其化合物的叙述正确的是( )A、氢氧化铝既能溶于盐酸又能溶于NaOH溶液 B、二氧化硅属于酸性氧化物,不能与任何酸反应 C、铝属于活泼金属,其化合物中一定存在离子键 D、硅酸是一种弱酸,可由二氧化硅与水化合制得7. 某同学运用元素周期表和周期律相关知识,推测铍及其化合物的性质:( )①原子半径大于硼 ②与酸反应时比锂剧烈 ③氢氧化铍的碱性比氢氧化钙弱 ④单质铍与冷水剧烈反应。其中正确的是
A、①②③④ B、①②③ C、①③ D、②④8. 下列关于化学键的叙述错误的是( )A、Na2SO4熔融时只破坏离子键 B、碘晶体升华时破坏分子内的共价键 C、所有铵盐都既含有共价键又含有离子键 D、CaO 与MgCl2中所含化学键类型完全相同9. 某原电池的总反应是 ,该原电池的正确组成是( )A、 B、
B、 C、
C、 D、
D、 10. 利用如图装置能达到相应实验目的的是( )
10. 利用如图装置能达到相应实验目的的是( )
选项
试剂a
试剂b
试剂c
实验目的
A
稀盐酸
NaHCO3
澄清石灰水
验证得电子能力Cl>C
B
浓氨水
生石灰
酚酞
证明NH3·H2O是弱碱
C
氯水
淀粉KI溶液
NaOH溶液
证明氧化性Cl>I
D
浓硝酸
石灰石
Na2SiO3溶液
验证得电子能力N>C>Si
A、A B、B C、C D、D11. 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数与次外层电子数之比为3:4。下列说法正确的是( )X
Y
Z
W
A、原子半径: W>Z>Y>X B、最高价氧化物对应水化物的酸性:W>Z C、最简单气态氢化物的热稳定性:X>Y>Z>W D、Y单质可将W从其盐的水溶液中置换出来12. 野外焊接钢轨常用如图所示装置,镁条引燃混合物后,反应非常剧烈,火星四射,有熔融铁珠落入沙子中。下列叙述错误的是( ) A、该反应属于置换反应 B、有“熔融铁珠”生成说明该反应为放热反应 C、该反应的化学能全部转化为热能 D、该反应中断键吸收的能量小于成键释放的能量13. 关于元素周期表的说法正确的是( )A、元素周期表中有8个主族 B、元素周期表中的短周期是指第一、二周期 C、最外层电子数为2的元素一定位于第ⅡA族 D、同周期相邻主族的元素原子序数不一定相差114. 某化学反应2A(g) B(g)+C(g)在三种不同条件下进行,B、C的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表数据所示,表中温度单位为摄氏度(℃)。下列叙述错误的是( )
A、该反应属于置换反应 B、有“熔融铁珠”生成说明该反应为放热反应 C、该反应的化学能全部转化为热能 D、该反应中断键吸收的能量小于成键释放的能量13. 关于元素周期表的说法正确的是( )A、元素周期表中有8个主族 B、元素周期表中的短周期是指第一、二周期 C、最外层电子数为2的元素一定位于第ⅡA族 D、同周期相邻主族的元素原子序数不一定相差114. 某化学反应2A(g) B(g)+C(g)在三种不同条件下进行,B、C的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表数据所示,表中温度单位为摄氏度(℃)。下列叙述错误的是( )实验序号
时间
浓度
温度
0
10
20
30
40
50
60
1
800
1.0
0.80
0.67
0.57
0.50
0.50
0.50
2
800
1.0
0.60
0.50
0.50
0.50
0.50
0.50
3
820
1.0
0.40
0.25
0.20
0.20
0.20
0.20
A、实验1、2用A表示10分钟内的速率比为v1:v2=1:2 B、实验1、2可知:实验2可能使用了催化剂或缩小容器体积 C、实验1、3可知:其他条件相同,升高温度,反应速率加快 D、实验1、2、3可知:使用催化剂或升温均可缩短达到平衡所用时间15. 下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )选项
A
B
C
D
物质
CH4
CaCl2
H2S
NH4NO3
化学键类型
共价键
离子键、共价键
离子键
离子键、共价键
化合物类型
共价化合物
离子化合物
离子化合物
共价化合物
A、A B、B C、C D、D16. 一定条件下,将1 molN2与3 molH2置于容积为2 L的恒容密闭容器中,发生反应:N2(g)+3H2(g) 2NH3(g),经过20 min,该反应达到平衡,此时容器中含有0.4 molNH3.下列说法正确的是( )A、20 min时,正、逆反应速率均为0 B、N2与H2浓度比不变,说明该反应已达平衡状态 C、20 min内,该反应平均速率v(H2)=0.03 mol/(L·min) D、20 min后,保持条件不变,NH3的浓度不变17. 已知W、X、Y、Z、M是短周期中原子序数依次增大的五种非金属元素。W元素的原子形成的离子核外电子数为0;X元素的原子最外层电子数是内层电子数的2倍;Y、Z元素在元素周期表中处于相邻的位置;M元素与Z元素处于同一主族,M元素的单质为黄色晶体。下列有关说法错误的是( )A、Z是地壳中含量最高的元素 B、X是形成化合物种类最多的元素 C、M单质在过量的Z单质中燃烧生成MZ3 D、W、Y形成的化合物能与Z、Y形成的化合物反应生成Y218. 在恒容密闭容器中发生反应C(s)+CO2(g) 2CO(g),下列有关叙述正确的是( )A、增加少量C,反应速率加快 B、充入一定量N2 , 容器内压强增大,反应速率加快 C、增加CO2或CO用量,反应速率加快 D、保持温度不变,反应达平衡前后,容器压强不变19. 为降低空气中可吸入颗粒物的含量,在路面喷洒XY2溶液作保湿剂。X质子数为20,X的阳离子与Y的阴离子电子层结构相同。Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。下列说法正确的是( )A、X的阳离子比Y的阴离子半径大 B、XY2和WZ2均属于离子化合物 C、H2Z比 HY热稳定性强 D、XY2中仅含离子键,WZ2中仅含极性共价键20. 向绝热恒容密闭容器中通入SO2和NO2 , 一定条件下使反应 达到平衡,正反应速率随时间变化的示意图如下所示。下列叙述正确的是( ) A、反应在c 点达到平衡状态 B、反应物浓度: 点小于 点 C、反应物的总能量低于生成物的总能量 D、 时,SO2的转化率: 段小于 段
A、反应在c 点达到平衡状态 B、反应物浓度: 点小于 点 C、反应物的总能量低于生成物的总能量 D、 时,SO2的转化率: 段小于 段二、综合题
-
21. 部分元素的性质与原子结构如下表:
元素编号
元素性质与原子(或分子)结构
W
最外层电子数是次外层电子数的3倍
X
位于第二周期,最高正价与最低负价代数和为2
Y
第三周期主族元素中原子中半径最大
Z
第三周期元素简单离子中半径最小
(1)、画出W的简单离子结构示意图。(2)、元素W与X相比,得电子能力较强的是(用元素符号表示),从原子结构角度解释原因是。(3)、元素W与元素Y能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式。(4)、Z的最高价氧化物对应的水化物既能与酸反应,又能与碱反应,用离子方程式表示出该物质分别与强酸、强碱的反应、。三、填空题
-
22. 氢能是一种极具发展潜力的清洁能源。3月29日,长城汽车氢能战略全球发布会推出氢能技术,并计划今年推出全球首款C级氢燃料电池SUV。关于氢能,根据要求回答问题:(1)、I.制备氢气
制备氢气常采用以下方法:
①电解水法:2H2O 2H2↑+O2↑
②水煤气法:C+H2O(g) CO+H2 , CO+H2O CO2+H2↑
③太阳能光催化分解水法:2H2O 2H2↑+O2↑
三种方法中最节能的是(填标号)。
(2)、已知拆开1 mol H -H、1 mol O=O和 1 mol H-О分别需要的能量依次为436kJ、498kJ和463kJ,则理论上每3.6 gH2O(g)完全分解,需(填“放出”或“吸收")能量kJ。下列能正确表示该过程的能量变化示意图的是(填标号)。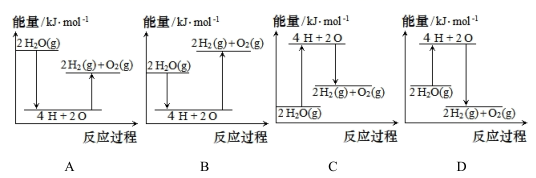 (3)、II.氢燃料电池
(3)、II.氢燃料电池氢燃料电池具有清洁高效等优点,其简易装置如下图所示。

该电池正极反应式为;反应过程中将能转化为能。
23. 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。(1)、I.将钠、镁各2 g分别投入盛足量冷水的烧杯中,实验结果:与冷水剧烈反应;另取镁、铝各2 g 分别投入足量0.05 mol/L盐酸中,与盐酸反应最剧烈。(2)、向Na2SiO3溶液中通入CO2出现胶状沉淀,可证明元素得电子能力> , 反应的离子方程式为。实验结论:随原子序数增大,同周期元素失电子能力依次(填“增强”或“减弱”,下同),得电子能力依次。
(3)、II.利用如图装置可验证同主族元素非金属性的变化规律。
仪器A的名称为。
(4)、若要证明非金属性:Cl>Br,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加KBr溶液和CCl4.反应一段时间后,将C振荡、静置,观察到C中现象是。此装置存在的不足之处是。24. 甲醇(CH3OH)是一种基本的有机化工原料,主要用于塑料、医药、农药、合成蛋白质等工业,工业上常用一氧化碳(CO)和氢气(H2)合成甲醇。一定温度下,在容积为2 L的某恒容密闭容器中充入一氧化碳和氢气两种气体进行反应,反应过程中各成分的相关数据如图所示。
回答下列问题:
(1)、该反应的化学方程式为。(2)、从反应开始至恰好达平衡时间内,CO的消耗速率为。(3)、反应达平衡时,H2的转化率为 , 容器内CH3OH 与CO的物质的量之比n(CH3OH):n(CO)= 。(4)、下列能说明该反应已达平衡状态的是(填字母标号)。a.容器内压强不变 b.v(CO)=v(CH3OH)
c.容器内气体密度不变 d.容器内气体平均相对分子质量不变
-