福建省南平市浦城县2020-2021学年高一下学期化学期中考试试卷
试卷更新日期:2021-06-04 类型:期中考试
一、单选题
-
1. 据报道,月球上有大量3He存在,以下关于3He的说法正确的是( )A、是4He的同素异形体 B、比4He多一个中子 C、是4He的同位素 D、比4He少一个质子2. 下列说法正确的是( )A、二氧化硅用来制造通讯材料一光导纤维 B、沙子、石英的主要成分是单质硅 C、SiO2可与盐酸发生反应 D、自然界里大量存在单质硅、二氧化硅和硅酸盐3. 在核反应中用α粒子(即氦核 He)轰击金属原子 X,得到核素 Y,开创了人造放射性核素的先河: X+ He→ Y+ n。其中元素X、Y的最外层电子数之和为8。下列叙述正确的是( )A、 X的相对原子质量为26 B、α粒子轰击金属原子 X发生了化学反应 C、X的原子半径小于Y的原子半径 D、X、Y均可形成三氯化物4. 根据元素周期表和元素周期律,下列推断中错误的是( )A、砹是一种有色固体,它的气态氢化物很不稳定, B、F2与水反应比Cl2与水反应剧烈 C、铷的硫酸盐易溶解于水,其氢氧化物一定是弱碱 D、氯化氢比溴化氢稳定,HClO4酸性强于HBrO45. 催化还原CO2是解决温室效应及能源问题的重要手段之一。在恒容密闭容器中,CO2和H2在催化剂作用下发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g)。CO2、H2、CH3OH、H2O的浓度均不再改变时,下列说法正确的是( )A、CO2、H2、CH3OH、H2O的浓度一定相等 B、该反应已经达到化学平衡状态 C、CO2和H2完全转化为CH3OH和H2O D、CO2、H2的反应速率等于CH3OH、H2O的反应速率且为零6. 短周期元素X、Y、Z在周期表中的位置如右图所示,则下列说法正确的是( )
 A、Z一定是活泼的金属元素 B、X的最高价氧化物的水化物是一种强酸 C、Y的气态氢化物最稳定 D、Z单质可与盐酸反应置换出氢气7. 下列有关化学用语的表示正确的是( )A、NH4Cl的电子式:
A、Z一定是活泼的金属元素 B、X的最高价氧化物的水化物是一种强酸 C、Y的气态氢化物最稳定 D、Z单质可与盐酸反应置换出氢气7. 下列有关化学用语的表示正确的是( )A、NH4Cl的电子式: B、S2-的结构示意图:
B、S2-的结构示意图:  C、氨的电子式:
C、氨的电子式:  D、碳元素位于第2周期,VIA族
8. 如图是课外活动小组设计用化学电源使LED灯发光的装置。下列说法错误的是( )
D、碳元素位于第2周期,VIA族
8. 如图是课外活动小组设计用化学电源使LED灯发光的装置。下列说法错误的是( ) A、铜片表面有气泡生成 B、装置中存在“化学能→电能→光能”的转换 C、如果将硫酸换成硫酸铜,导线中不会有电子流动 D、如果将锌片换成铁片,电路中的电流方向不变9. 下列反应既属于氧化还原反应,又是吸热反应的是( )A、锌粒与稀硫酸的反应 B、Ba(OH)2·8H2O晶体与NH4Cl晶体的反应 C、甲烷在氧气中的燃烧反应 D、灼热的木炭与CO2反应10. 在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子可能是( )
A、铜片表面有气泡生成 B、装置中存在“化学能→电能→光能”的转换 C、如果将硫酸换成硫酸铜,导线中不会有电子流动 D、如果将锌片换成铁片,电路中的电流方向不变9. 下列反应既属于氧化还原反应,又是吸热反应的是( )A、锌粒与稀硫酸的反应 B、Ba(OH)2·8H2O晶体与NH4Cl晶体的反应 C、甲烷在氧气中的燃烧反应 D、灼热的木炭与CO2反应10. 在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子可能是( ) A、Mg2+、Al3+、Fe3+ B、Na+、Mg2+、Al3+ C、H+、Ba2+、Al3+ D、H+、Mg2+、Al3+11. 下列措施对增大反应速率明显有效的是( )A、Na与水反应时增大水的用量 B、Fe与稀硫酸反应制取H2时,改用浓硫酸 C、在K2SO4与BaCl2两溶液反应时,增大反应容器体积 D、Al在氧气中燃烧生成Al2O3 , 将Al片改成Al粉12. 下列装置能够组成原电池的是( )A、
A、Mg2+、Al3+、Fe3+ B、Na+、Mg2+、Al3+ C、H+、Ba2+、Al3+ D、H+、Mg2+、Al3+11. 下列措施对增大反应速率明显有效的是( )A、Na与水反应时增大水的用量 B、Fe与稀硫酸反应制取H2时,改用浓硫酸 C、在K2SO4与BaCl2两溶液反应时,增大反应容器体积 D、Al在氧气中燃烧生成Al2O3 , 将Al片改成Al粉12. 下列装置能够组成原电池的是( )A、 B、
B、 C、
C、 D、
D、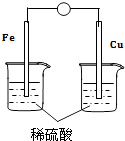 13. 下列实验现象不能充分说明相应的化学反应是放热反应的是( )
13. 下列实验现象不能充分说明相应的化学反应是放热反应的是( )选项
A
B
C
D
反应装置或图像




实验现象或图像信息
反应开始后,针筒活塞向右移动
反应开始后,甲侧液面低于乙侧液面
温度计的水银柱上升
反应开始后,气球慢慢胀大
A、A B、B C、C D、D14. 反应4NH3+5O2 4NO+6H2O在2L的密闭容器中进行,10秒后,H2O的物质的量增加了0.3mol,则此反应的平均反应速率v(X)为( )A、v(O2)=0.75mol·L-1·min-1 B、v(NH3)=0.02mol·L-1·s-1 C、v(NO)=0.1mol·L-1·s-1 D、v(H2O)=0.09mol·L-1·min-115. 中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(—种固体催化剂)合成NH3的原理示意图如图。下列说法错误的是( ) A、该过程将太阳能转化成为化学能 B、氧化剂与还原剂的物质的量之比为1:3 C、该过程中,涉及离子键和共价键的断裂与生成 D、原料气N2可通过分离液态空气获得16. 一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是( )
A、该过程将太阳能转化成为化学能 B、氧化剂与还原剂的物质的量之比为1:3 C、该过程中,涉及离子键和共价键的断裂与生成 D、原料气N2可通过分离液态空气获得16. 一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是( ) A、反应的化学方程式为2X=3Y+Z B、t时,正、逆反应都不再继续进行,反应达到化学平衡 C、若t=4,则0~t X的化学反应速率为0.1mol/(L·min) D、温度、体积不变,t时刻充入1mol He使压强增大,正、逆反应速率都增大
A、反应的化学方程式为2X=3Y+Z B、t时,正、逆反应都不再继续进行,反应达到化学平衡 C、若t=4,则0~t X的化学反应速率为0.1mol/(L·min) D、温度、体积不变,t时刻充入1mol He使压强增大,正、逆反应速率都增大二、综合题
-
17. 如表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列各题。
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
⑥
⑧
⑩
3
①
③
⑤
⑦
⑨
4
②
④
(1)、这10种元素中,化学性质最不活泼的元素是(写元素符号),得电子能力最强的原子是(写元素符号),失电子能力最强的单质与水反应的化学方程式是。(2)、元素④的离子结构示意图为。(3)、⑦最高价氧化物对应水化物的化学式为:。(4)、①和⑤两种元素最高价氧化物对应的水化物相互反应的离子方程式为:。②和⑨两种元素最高价氧化物对应的水化物相互反应的化学方程式为:。(5)、写出⑦、⑧、⑨元素气态氢化物的化学式并按稳定性由强到弱排序:。18. 欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如图所示。 (1)、Si在周期表中的位置是。(2)、下列说法正确的是。
(1)、Si在周期表中的位置是。(2)、下列说法正确的是。a.酸性:H2CO3>H2SiO3
b.原子半径:O<C<Al<Si
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)、该矿石的组成是 , 滤渣和NaOH溶液反应的离子方程式是。(4)、工业上依据上述实验原理处理该矿石,若不慎将反应池的气体逸出与空气混合会生成红棕色有毒气体是;若处理该矿石4.68×103kg,得到滤渣1.2×103kg,理论上至少需要1mol·L-1HNO3的体积为 L。19. 从海水中可以获得淡水、食盐并可提取镁和溴等物质。“吹出法”提溴:空方气吹出法是工业规模提溴的常用法,其流程如图: (1)、其中步骤②~⑤的目的是。步骤④反应的离子方程式为 。除SO2外,步骤④还可以选用Na2CO3溶液吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收3molBr2时,转移电子的物质的量为mol。(2)、实验室模拟从海带中提取碘,可能经历如下操作(或过程),请选择必要的操作(或过程不需要的不选),并按实验的先后顺序排列(填写编号)。
(1)、其中步骤②~⑤的目的是。步骤④反应的离子方程式为 。除SO2外,步骤④还可以选用Na2CO3溶液吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收3molBr2时,转移电子的物质的量为mol。(2)、实验室模拟从海带中提取碘,可能经历如下操作(或过程),请选择必要的操作(或过程不需要的不选),并按实验的先后顺序排列(填写编号)。 20. 某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
20. 某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验操作步骤:
①打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
②A中看到白色沉淀时,…,关闭活塞a。
请回答:
(1)、B中反应的离子方程式是。(2)、通过步骤①、②得知盐酸具有的性质是(填字母)。A.挥发性 B.还原性 C.氧化性 D.酸性
(3)、C装置的作用是 , X是(写化学式)。(4)、为了验证碳的非金属性强于硅,步骤②中未写的操作和现象是。(5)、D中反应的化学方程式是。21.(1)、已知断开或形成1molH—H键、1molBr—Br键、1molH—Br键的能量变化分别为436kJ、193kJ、366kJ。计算H2和Br2反应生成1molHBr需放出能量 kJ。(2)、如图是某兴趣小组设计的原电池示意图,实验结束后,在实验报告上记录信息如图:
a.电流计指针偏转
b.Cu极有H2产生
c.H+向负极移动
d.电流由Zn经导线流向Cu
①实验报告中记录合理的是(填序号)。
②请写出该电池的负极反应式。
③若有1mol电子流过导线,则理论上产生H2的质量为g。