四川省成都市郫都区2020-2021学年高二下学期化学期中考试试卷
试卷更新日期:2021-06-04 类型:期中考试
一、单选题
-
1. 下列说法正确的是( )A、化学电源均无害 B、化学电源即为可充电电池 C、太阳能电池不是化学电池 D、化学电池所提供的电能居于人类社会现阶段总耗电量的首位2. 下列硼(B)原子电子排布式表示的状态中,能量最高是( )A、 B、 C、 D、3. 下列有关金属腐蚀的说法,正确的是( )A、化学腐蚀比电化学腐蚀要普遍得多 B、化学腐蚀和电化学腐蚀不可能同时发生 C、化学腐蚀比电化学腐蚀的腐蚀速度要快得多 D、电化学腐蚀过程伴随有电流产生,而化学腐蚀过程没有4. 下列叙述正确的是( )A、钠的焰色反应呈现黄色,是电子由激发态转化成基态时吸收能量产生的 B、原子轨道和电子云都是用来形象地描述电子运动状态的 C、各能层的s电子云轮廓图都是圆形,但圆的半径大小不同 D、同一原子中,2p、3p、4p能级的轨道数依次增多5. 港珠澳大桥桥体的钢构件采用了多种防腐方法。有关其分析正确的是( )A、越靠近海底的钢构件,腐蚀越严重 B、钢构件上镶嵌铝块,属牺牲阳极阴极保护法 C、钢构件若腐蚀,正极反应式为:Fe-2e-=Fe2+ D、钢构件表面喷涂环氧树脂涂层,防止形成电解池6. 铍(4Be)的右下角元素是铝,根据“对角线规则”,下列描述错误的( )A、BeO是两性氧化物 B、已知AlCl3是共价化合物,则BeCl2也可能是共价化合物 C、Be(OH)2既能与H2SO4溶液反应也能与NaOH溶液反应 D、Be(OH)2与NaOH溶液反应后生成NaBeO2和H2O7. 硒(34Se)是人体必需的微量元素,它能有效提高人体免疫机能,抑制癌症和心脑血管等疾病的发病率,下列有关说法错误的是( )A、硒元素位于元素周期表中第15列 B、基态硒元素原子核外电子所占据的最高能级的电子云轮廓图为哑铃形 C、硒的最高价氧化物对应的水化物的化学式为H2SeO4 D、O和Se均为p区非金属元素8. “天问一号”于2021年2月被火星捕获。火星大气中含有羰基硫(COS)分子,其结构与 相似,关于羰基硫的说法正确的是( )A、比例模型:
 B、结构式:
C、共用电子对都偏向碳
D、是含有极性键的非极性分子
9. 能用键能解释,且结论正确的是( )A、熔点:金刚石>晶体硅 B、分子稳定性:H2O>HF C、水中的溶解度:SO2>CO2 D、状态:常温时,Cl2是气态,Br2为液态10. 下列叙述正确的是( )A、电负性:S>Cl B、键角:NH3<H2O C、中心原子杂化轨道数: D、键长:HF<HCl11. 不能支持石墨是晶体这一事实的选项是( )A、石墨和金刚石互为同素异形体 B、石墨中的碳原子呈周期性有序排列 C、石墨的熔点为3 850 ℃ D、在石墨的X射线衍射图谱上有明锐的谱线12. 下列说法错误的是( )A、s-sσ键与p-pσ键的电子云图像都呈轴对称 B、s轨道与s轨道不能形成π键,p轨道与p轨道能形成π键 C、1,3丁二烯(CH2=CH-CH=CH2)分子中含有7个σ键2个π键 D、乙烯与乙烷化学性质不同,主要是因为乙烯中的π键不如σ键牢固13. 下列判断中错误的是( )A、熔融态能够导电的晶体一定是离子晶体 B、不同族元素氧化物可形成同类晶体 C、同族元素氧化物可形成不同类型晶体 D、氯化铵固体属于离子晶体,加热使其分解时破坏了离子键和共价键14. 图a、b、c分别为氯化钠在不同状态下的导电实验的微观示意图(X、Y均表示石墨电极,且与直流电源连接方式相同,
B、结构式:
C、共用电子对都偏向碳
D、是含有极性键的非极性分子
9. 能用键能解释,且结论正确的是( )A、熔点:金刚石>晶体硅 B、分子稳定性:H2O>HF C、水中的溶解度:SO2>CO2 D、状态:常温时,Cl2是气态,Br2为液态10. 下列叙述正确的是( )A、电负性:S>Cl B、键角:NH3<H2O C、中心原子杂化轨道数: D、键长:HF<HCl11. 不能支持石墨是晶体这一事实的选项是( )A、石墨和金刚石互为同素异形体 B、石墨中的碳原子呈周期性有序排列 C、石墨的熔点为3 850 ℃ D、在石墨的X射线衍射图谱上有明锐的谱线12. 下列说法错误的是( )A、s-sσ键与p-pσ键的电子云图像都呈轴对称 B、s轨道与s轨道不能形成π键,p轨道与p轨道能形成π键 C、1,3丁二烯(CH2=CH-CH=CH2)分子中含有7个σ键2个π键 D、乙烯与乙烷化学性质不同,主要是因为乙烯中的π键不如σ键牢固13. 下列判断中错误的是( )A、熔融态能够导电的晶体一定是离子晶体 B、不同族元素氧化物可形成同类晶体 C、同族元素氧化物可形成不同类型晶体 D、氯化铵固体属于离子晶体,加热使其分解时破坏了离子键和共价键14. 图a、b、c分别为氯化钠在不同状态下的导电实验的微观示意图(X、Y均表示石墨电极,且与直流电源连接方式相同,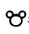 表示水分子)。下列说法正确的是( )
表示水分子)。下列说法正确的是( ) 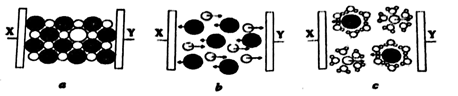 A、Y电极为阳极 B、能导电的装置中,Y电极产物不相同 C、NaCl是电解质,三种状态下都能导电 D、图b说明通电后发生了电离15. 锂碘电池可用于心脏起搏器,电池反应可简化为: ;电池工作时,下列说法正确的是( )A、碘电极是电池的负极 B、锂电极发生还原反应 C、锂碘电池比能量高 D、电池正极反应:16. 二氟化二氧(O2F2)是一种极强的氧化剂和氟化剂,分子结构与过氧化氢相似,性质极其不稳定,可以发生反应: 。下列有关说法错误的是( )A、离子半径:S2->O2->F- B、O2F2分子中氧原子的价层电子对数为4 C、O2F2分子中极性键与非极性键数目之比为2:1 D、HF在标准状况下呈液态,主要原因是极性较强,范德华力较大17. Zn与Cu置于CuSO4溶液中可以构成原电池,如图M所示,实验发现电流表指针发生偏转,但是Zn表面仍有红色铜吸附,有同学做出如图改进,如图N所示。下列说法正确的是( )
A、Y电极为阳极 B、能导电的装置中,Y电极产物不相同 C、NaCl是电解质,三种状态下都能导电 D、图b说明通电后发生了电离15. 锂碘电池可用于心脏起搏器,电池反应可简化为: ;电池工作时,下列说法正确的是( )A、碘电极是电池的负极 B、锂电极发生还原反应 C、锂碘电池比能量高 D、电池正极反应:16. 二氟化二氧(O2F2)是一种极强的氧化剂和氟化剂,分子结构与过氧化氢相似,性质极其不稳定,可以发生反应: 。下列有关说法错误的是( )A、离子半径:S2->O2->F- B、O2F2分子中氧原子的价层电子对数为4 C、O2F2分子中极性键与非极性键数目之比为2:1 D、HF在标准状况下呈液态,主要原因是极性较强,范德华力较大17. Zn与Cu置于CuSO4溶液中可以构成原电池,如图M所示,实验发现电流表指针发生偏转,但是Zn表面仍有红色铜吸附,有同学做出如图改进,如图N所示。下列说法正确的是( )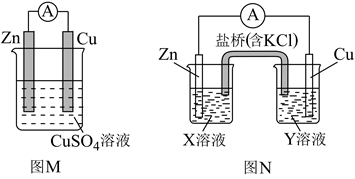 A、图N中X溶液为CuSO4溶液 B、图N盐桥中Cl-向右池移动 C、图M中,反应一段时间后,溶液质量增加 D、图M中,实际消耗Zn的质量等于Zn极减少的质量18. 方英石(SiO2)结构和金刚石相似,其结构单元如图,下列有关说法正确的是( )
A、图N中X溶液为CuSO4溶液 B、图N盐桥中Cl-向右池移动 C、图M中,反应一段时间后,溶液质量增加 D、图M中,实际消耗Zn的质量等于Zn极减少的质量18. 方英石(SiO2)结构和金刚石相似,其结构单元如图,下列有关说法正确的是( )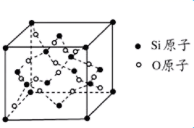 A、图示结构单元中实际占有18个硅原子 B、1 mol Si形成2 mol Si—O键 C、方英石晶体中的Si采用的是sp3杂化 D、方英石晶体中,Si-O键之间的夹角为90°19. 金晶体的晶胞如图所示,设金原子的直径为d,用NA表示阿伏加德罗常数,在立方体的各个面的对角线上,3个金原子彼此两两相切,M表示金的摩尔质量。则下列说法错误的是( )
A、图示结构单元中实际占有18个硅原子 B、1 mol Si形成2 mol Si—O键 C、方英石晶体中的Si采用的是sp3杂化 D、方英石晶体中,Si-O键之间的夹角为90°19. 金晶体的晶胞如图所示,设金原子的直径为d,用NA表示阿伏加德罗常数,在立方体的各个面的对角线上,3个金原子彼此两两相切,M表示金的摩尔质量。则下列说法错误的是( ) A、金晶体每个晶胞中含有4个金原子 B、金属键无方向性,金晶体属于最密堆积 C、晶体中金原子的配位数是12 D、一个晶胞的体积是20. 利用如图所示装置(示意图),当X、Y选用不同材料时,可将电解原理广泛用于工业生产。下列说法中错误的是( )
A、金晶体每个晶胞中含有4个金原子 B、金属键无方向性,金晶体属于最密堆积 C、晶体中金原子的配位数是12 D、一个晶胞的体积是20. 利用如图所示装置(示意图),当X、Y选用不同材料时,可将电解原理广泛用于工业生产。下列说法中错误的是( )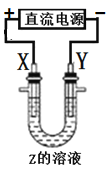 A、氯碱工业中,Y附近能得到氢氧化钠溶液 B、铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 C、电镀工业中,Y是待镀金属,X是镀层金属 D、外加电流的阴极保护法中,Y是待保护金属21. 一种新型太阳光电化学电池贮能时电解质溶液中离子在两极发生如图所示的转化。下列说法正确的是( )
A、氯碱工业中,Y附近能得到氢氧化钠溶液 B、铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 C、电镀工业中,Y是待镀金属,X是镀层金属 D、外加电流的阴极保护法中,Y是待保护金属21. 一种新型太阳光电化学电池贮能时电解质溶液中离子在两极发生如图所示的转化。下列说法正确的是( )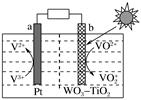 A、贮能时,电能转变为化学能和光能 B、贮能和放电时,电子在导线中流向相同 C、贮能时,氢离子由a极区迁移至b极区 D、放电时,b极发生:VO +2H++e-=VO2++H2O22. 某新型电池可净化废水,同时还能获得能源或有价值的化学产品,其工作原理如图所示,下列叙述错误的是( )
A、贮能时,电能转变为化学能和光能 B、贮能和放电时,电子在导线中流向相同 C、贮能时,氢离子由a极区迁移至b极区 D、放电时,b极发生:VO +2H++e-=VO2++H2O22. 某新型电池可净化废水,同时还能获得能源或有价值的化学产品,其工作原理如图所示,下列叙述错误的是( )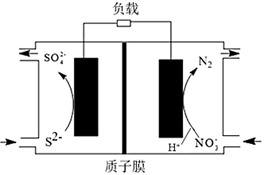 A、该电池左室电极为负极 B、电池工作时,右侧电极上发生还原反应 C、电池工作时,可同时处理两种不同的废水 D、左池消耗的S2-与右池消耗的 的物质的量之比为8:523. 最近科学家采用碳基电极材料设计了一种电解氯化氢回收氯气的新工艺,其原理如图,下列说法错误的是( )
A、该电池左室电极为负极 B、电池工作时,右侧电极上发生还原反应 C、电池工作时,可同时处理两种不同的废水 D、左池消耗的S2-与右池消耗的 的物质的量之比为8:523. 最近科学家采用碳基电极材料设计了一种电解氯化氢回收氯气的新工艺,其原理如图,下列说法错误的是( ) A、电源b端为正极 B、 对总反应起催化作用 C、阳极发生的电极反应式为 D、电路中转移 ,需要消耗 (标准状况)24. 工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为情性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )
A、电源b端为正极 B、 对总反应起催化作用 C、阳极发生的电极反应式为 D、电路中转移 ,需要消耗 (标准状况)24. 工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为情性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )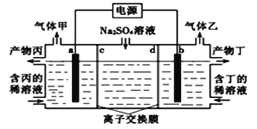 A、a极与电源的负极相连 B、产物丙为氢氧化钠溶液 C、d为阴离子交换膜 D、通入含丙、丁的稀溶液的目的是增强溶液的导电性
A、a极与电源的负极相连 B、产物丙为氢氧化钠溶液 C、d为阴离子交换膜 D、通入含丙、丁的稀溶液的目的是增强溶液的导电性二、综合题
-
25. 已知:有U、V、W、X、Y、Z六种前四周期元素,其原子序数依次增大,其部分信息如下表:
U
原子核外电子只存在一种运动状态
V
简单氢化物能与最高价氧化物对应的水合物反应生成盐
W
基态原子的价电子排布为nsnnp2n
X
单质X2:常温下为黄绿色的有毒气体
Y
主族金属元素;各能层s能级上电子总数与各能层p能级上电子总数之比为2:3
Z
前四周期的基态原子中核外未成对电子数最多
请用相应的化学用语回答下列问题:
(1)、YU2的电子式为。(2)、Z位于元素周期表第周期族;基态Z原子结构示意图为。(3)、现有UXW、UVW2和UVW3三种物质,它们的酸性由强到弱的顺序为。(4)、实验证明,接近水的沸点的水蒸气的相对分子质量测定值比用化学式H2O计算出来的相对分子质量大一些,其主要原因是。(5)、Y(VW2)2中各元素第一电离能由小到大的顺序为 , 阴离子的立体构型为。在酸性溶液中Y(VW2)2会发生自身氧化还原反应,产物之一是VW,该反应的离子方程式为。26. 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。(1)、Ni元素位于周期表中区,基态Ni2+外围电子排布图是。(2)、Ni(CO)4常用作制备高纯镍粉,常温下为液态,易溶于CCl4、苯等有机溶剂。则:①Ni(CO)4固态时属于晶体(填晶体类型)
②已知CO与N2互为等电子体,则Ni(CO)4中σ键和π键的数目之比为 , 请事写出一种与CO互为等电子体的阴离子的化学式。
(3)、NiSO4常用于电镀工业,丁二酮肟(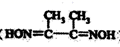 )是检验Ni2+的灵敏试剂,其中碳原子不存在杂化(填“sp”、“sp2”或“sp3”)。 (4)、NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙中,已知晶胞边长为a pm,阿伏加德罗常数为NA , NiO晶体的密度为g/cm3(只列出计算式)。
)是检验Ni2+的灵敏试剂,其中碳原子不存在杂化(填“sp”、“sp2”或“sp3”)。 (4)、NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙中,已知晶胞边长为a pm,阿伏加德罗常数为NA , NiO晶体的密度为g/cm3(只列出计算式)。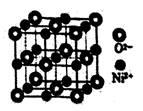 (5)、NiO、FeO的晶体结构类型均与氯化钠的相同,熔点NiO>FeO,则离子半径r(Ni2+)r(Fe2+)(填“<”或“”>),请简述判断理由。27. 铅蓄电池、镍镉碱性充电电池都是重要的二次电池。已知:
(5)、NiO、FeO的晶体结构类型均与氯化钠的相同,熔点NiO>FeO,则离子半径r(Ni2+)r(Fe2+)(填“<”或“”>),请简述判断理由。27. 铅蓄电池、镍镉碱性充电电池都是重要的二次电池。已知:①铅蓄电池总的化学方程式为: ,使用(放电)段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用;
②镍镉碱性充电电池放电时,正极反应为: ,负极反应式: ,使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用;
回答下列问题:
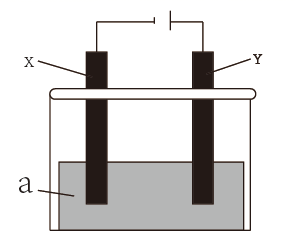
(1)、铅蓄电池负极板上覆盖的物质是(填名称),充电时,PbSO4在(填“阳极”、“阴极”或“两个电极”)上(填“生成或除去”)。(2)、镍镉碱性充电电池在充电时的总反应的化学方程式为。(3)、铅蓄电池和镍镉碱性充电电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变的主要原因可能是。(4)、现用铅蓄电池作为电源,连成如图所示装置,其中a为电解质溶液,X、Y是两块电极板,①若X、Y都是惰性电极,a是CuSO4溶液,电解一段时间后,阴极只析出6.4g固体,则需要加入(填化学式)即可恢复电解质溶液的浓度。
②可用该装置在实验室模拟铝制品表面“钝化”处理,可使铝制品表面形成较致密的氧化膜以更好地保护铝制品,a是稀硫酸溶液,写出Y电极上发生的电极反应式。
 28. 氮氧化物的任意排放会造成酸雨、光化学烟雾等环境污染问题,有效处理氮氧化物目前已经成为一项重要的研究课题。(1)、Ⅰ.利用燃料电池的原理来处理氮氧化物是一种方向。装置如图所示,在处理过程中石墨电极Ⅰ上反应生成一种氧化物Y。
28. 氮氧化物的任意排放会造成酸雨、光化学烟雾等环境污染问题,有效处理氮氧化物目前已经成为一项重要的研究课题。(1)、Ⅰ.利用燃料电池的原理来处理氮氧化物是一种方向。装置如图所示,在处理过程中石墨电极Ⅰ上反应生成一种氧化物Y。写出氧化物Y的化学式。
(2)、电流的流向:石墨Ⅰ石墨Ⅱ(填“→”或“←”);石墨Ⅱ的电极反应式为。(3)、当外电路每转移2 mol e-时理论上可以处理标准状况下的NO2L。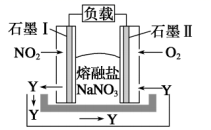 (4)、Ⅱ.用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图所示(质子膜允许H+和H2O通过)
(4)、Ⅱ.用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图所示(质子膜允许H+和H2O通过)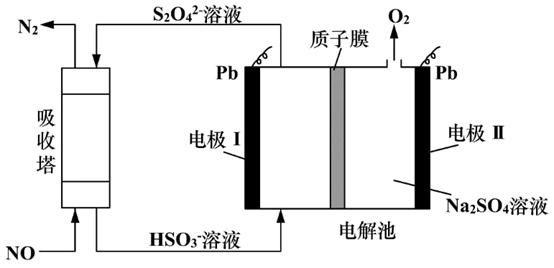
图中电极Ⅰ应接电源的(填“正极”或“负极”),接通电源工作一段时间后,电极Ⅰ附近的pH将(填“增大”、“减小”或“不变”)。
(5)、吸收塔中发生反应的离子方程式为。