湖北省蕲春县2020-2021学年高二下学期化学期中考试试卷
试卷更新日期:2021-06-04 类型:期中考试
一、单选题
-
1. 我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )A、萃取 B、渗析 C、干馏 D、蒸馏2. 基态R原子的 能级上只有一对成对电子,则R的最高价氧化物对应水化物的酸根离子是( )A、 B、 C、 D、3. 人类最早冶金的历史年代曲线图如图所示( 表示公元前1000年):下列说法正确的是( )
 A、金属越活泼,冶炼的年代一定越晚 B、冶炼金属的历史:电解氯化物比电解氧化物早 C、自然界中铜元素以游离态形式存在,故铜的冶炼年代最早 D、金属氧化物(如 、 )也属于金属材料4. 分类法在化学发展中起到了非常重要的作用,下列说法正确的是( )A、 可以分别用置换法、直接加热法和电解法冶炼得到 B、向煮沸的 溶液中逐滴加入少量饱和 溶液,可制得 胶体 C、酸性氧化物一定是非金属氧化物,混合物、分散系、胶体有从属关系 D、 可与 反应生成 和水,故 属于酸性氧化物5. 下列氢化物分子内共价键的极性由强到弱的顺序正确的是( )A、 B、 C、 D、6. 下列实验装置能达到相应实验目的的是( )
A、金属越活泼,冶炼的年代一定越晚 B、冶炼金属的历史:电解氯化物比电解氧化物早 C、自然界中铜元素以游离态形式存在,故铜的冶炼年代最早 D、金属氧化物(如 、 )也属于金属材料4. 分类法在化学发展中起到了非常重要的作用,下列说法正确的是( )A、 可以分别用置换法、直接加热法和电解法冶炼得到 B、向煮沸的 溶液中逐滴加入少量饱和 溶液,可制得 胶体 C、酸性氧化物一定是非金属氧化物,混合物、分散系、胶体有从属关系 D、 可与 反应生成 和水,故 属于酸性氧化物5. 下列氢化物分子内共价键的极性由强到弱的顺序正确的是( )A、 B、 C、 D、6. 下列实验装置能达到相应实验目的的是( )实装验置




实目验的
A.除去 中的
B.制备并收集NO
C.测定中和反应的反应热
D.制取
A、A B、B C、C D、D7. 下列化学用语对事实的表述正确的是( )A、向 和 的混合溶液中加入少量的 B、碱性锌锰干电池的正极反应式: C、向 溶液中加少量 溶液: D、磁性氧化铁溶于浓硝酸:8. X和Y都为主族元素,其价电子数分别为1和5,下列判断正确的是( )A、X一定是s区元素,Y一定是p区元素 B、X、Y形成的化合物一定为共价化合物 C、Y的电负性一定大于X的电负性 D、基态时,X原子的第一电离能一定小于Y原子的第一电离能9. 下列关于有机物的叙述正确的是( )A、任何有机化合物所含元素中,碳元素的质量分数都是最高的 B、最简式相同且所含元素种类相同的化合物互为同系物 C、有机化合物的相对分子质量越大,其熔、沸点越高 D、0.6g某有机物完全燃烧后生成 和 ,说明该有机物一定含C,H,O三种元素10. 短周期主族元素L、X、Y、Z、W的原子序数依次增大,L和Y位于同一主族且L是元素周期表中原子半径最小的元素,X、Z、W三种元素在元素周期表中的相对位置如图且常见的W的单质为气体。下列叙述正确的是( )X
Z
W
A、由L、X、Y、Z四种元素形成的盐 的水溶液显酸性 B、简单离子半径: C、Z、W的氧化物对应的水化物均为强酸 D、X、Z、W分别与L形成的最简单化合物中,W与L形成的化合物的沸点最高11. 代表阿伏加德罗常数的值,下列说法正确的是( )A、将 溶于水,溶液中阳离子总数为 B、将 与足量的甲烷在光照条件下充分反应,直至混合气体变为无色,生成 的数目为 C、向 的 溶液中通入适量氨气至中性,此时溶液中 的数目为 D、标准状况下, 由 和 组成的混合气体中分子总数为12. 烃分子中,碳原子连三个氢原子时称为伯碳原子,连两个氢原子时称为仲碳原子,连一个氢原子时称为叔碳原子,不连氢原子时称为季碳原子。某烷烃分子中有m个伯碳原子,n个仲碳原子,a个季碳原子,则该烷烃分子中叔碳原子的数目是( )A、 B、 C、 D、13. 某二甲醚 /双氧水燃料电池的工作原理如图所示(电极a、b均为惰性电极)。下列说法正确的是( )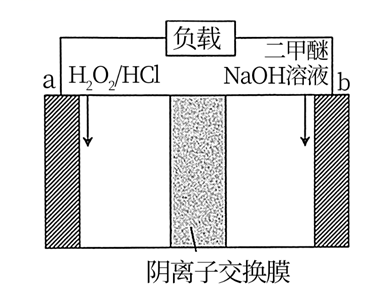 A、电池工作时,外电路中电子的流向:a→负载→b B、电极b上的电极反应式: C、电池工作时,电极a附近溶液的 增大 D、电池工作时,右侧工作室的 向左侧工作室迁移14. 高铁酸钾 为暗紫色粉末,极易溶于水,在强碱性溶液中相当稳定,中性条件下与水反应 。高铁酸钾是极好的氧化剂,是一种新型非氯高效消毒剂,常用于饮用水处理。实验室中模拟高铁酸钾的生产流程如图:
A、电池工作时,外电路中电子的流向:a→负载→b B、电极b上的电极反应式: C、电池工作时,电极a附近溶液的 增大 D、电池工作时,右侧工作室的 向左侧工作室迁移14. 高铁酸钾 为暗紫色粉末,极易溶于水,在强碱性溶液中相当稳定,中性条件下与水反应 。高铁酸钾是极好的氧化剂,是一种新型非氯高效消毒剂,常用于饮用水处理。实验室中模拟高铁酸钾的生产流程如图:
下列说法错误的是( )
A、 在反应中生成的 胶体,能够吸附水中的悬浮物质 B、反应Ⅲ中,每生成 转移的电子为 C、当 与水反应时,标准状况下生成 的体积为 D、 能够将 氧化为 ,氧化剂与还原剂的物质的量之比为15. 砷化硼 是一种具有超高热导率的新型半导体材料,其制备原理为 。下列说法错误的是( )

 A、图a表示 结构, 分子中成键电子对与孤电子对的数目之比为3:1 B、图b表示晶态单质硼 的基本结构单元,该基本结构单元为正二十面体 C、图c表示 晶胞结构, 原子的配位数为4 D、该反应所涉及的元素中,I的原子半径最大
A、图a表示 结构, 分子中成键电子对与孤电子对的数目之比为3:1 B、图b表示晶态单质硼 的基本结构单元,该基本结构单元为正二十面体 C、图c表示 晶胞结构, 原子的配位数为4 D、该反应所涉及的元素中,I的原子半径最大二、综合题
-
16. 实验室利用反应 制取乙烯,图1为乙烯的制取及乙烯还原性的验证装置图。

请回答下列问题:
(1)、将量好的浓硫酸和乙醇在烧杯中混合时,需要用到的玻璃仪器是。(2)、碎瓷片的作用是 , 若实验中加热一段时间后发现忘记加碎瓷片,则应该采取的措施是。(3)、能够说明乙烯具有还原性的现象是。(4)、实验中,因浓硫酸具有性,故烧瓶内产生的气体中还可能含①、② , (填分子式)为检验可能产生的气体,设计如图2所示装置进行检验,将图1装置(填“甲”、“乙”或“丙”)中溶液转移到图2的锥形瓶中,打开分液漏斗活塞,进行实验。则能说明有气体①产生的实验现象是 , 能说明有气体②产生的实验现象是。17. 某化合物 的合成路线如下: 已知:①F的分子式 且核磁共振氢谱显示F只有两组峰,且峰面积之比为 ;
已知:①F的分子式 且核磁共振氢谱显示F只有两组峰,且峰面积之比为 ;②

回答下列问题:
(1)、A的系统命名为 , 的反应类型为。(2)、F的结构简式为 , 的反应类型为。(3)、D含有官能团的名称为 ,(4)、 的化学方程式为。(5)、下列有关化合物E的说法正确的是(填标号)。a.与 互为同分异构体
b.在一定条件可发生加聚反应,所得聚合物为纯净物
c.同系物中:碳原子数越多,支链数越多,沸点越高
d.分子中所有的碳原子一定在同一平面上
(6)、有机化合物M与G互为同分异构体(不考虑立体异构体),则:①M中含有碳氧双键的结构有种。
②M中含有羟基和碳碳双键的结构有种(形成碳碳双键的碳原子不与羟基相连)。
18. 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,制备亚氯酸钠的工艺流程如下:
回答下列问题:
(1)、亚氯酸钠用作纸浆、纸张和各种纤维的漂白剂,是一种高效漂白剂,主要原因是亚氯酸钠具有性。(2)、制备ClO2气体的化学方程式为 ;制备时可用S代替H2O2 , 写出该反应的离子方程式:。但“吸收”时却不宜用S代替H2O2 , 理由是。(3)、可从“废液”中回收的主要物质是(填化学式),“结晶”后经过滤即可获得粗产品。(4)、测定某亚氯酸钠样品的纯度:准确称取亚氯酸钠样品mg,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量稀硫酸(发生反应 ,配成250 mL待测液。移取25. 00 mL待测液于锥形瓶中,加几滴淀粉溶液,用c 的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液V mL(已知: )。①移取25. 00 mL待测液的仪器的名称是。
②在接近滴定终点时,使用“半滴操作”可提高测定的准确度,其操作方法是将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,(请在横线上补全操作),继续摇动锥形瓶,观察溶液颜色变化。
③该样品中NaClO2的质量分数为(用含m、c、V的代数式表示);在滴定操作正确无误的情况下,此实验测得结果偏高,其可能的原因是。
19. 据报道,我国化学研究人员用 和 等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
请回答下列问题:
 (1)、基态 原子的基态电子排布式为 , 在元素周期表中的位置是。(2)、C、N、O三种元素第一电离能最大的是(填元素符号),C在形成化合物时,其键型以共价键为主,其原因是。(3)、镍的一维链状配位聚合物中,碳原子的杂化方式为。已知: 的沸点为117.9℃, 的沸点为32℃。 的沸点高于 的沸点的主要原因是。(4)、 的阴离子为 ,中心原子N原子的 键电子对数为。阴离子 的空间构型是。(5)、氧化镍的晶胞结构如图所示。若 为阿伏加德罗常数的值,晶胞中最近的 之间的距离为 ,则氧化镍的密度为 。
(1)、基态 原子的基态电子排布式为 , 在元素周期表中的位置是。(2)、C、N、O三种元素第一电离能最大的是(填元素符号),C在形成化合物时,其键型以共价键为主,其原因是。(3)、镍的一维链状配位聚合物中,碳原子的杂化方式为。已知: 的沸点为117.9℃, 的沸点为32℃。 的沸点高于 的沸点的主要原因是。(4)、 的阴离子为 ,中心原子N原子的 键电子对数为。阴离子 的空间构型是。(5)、氧化镍的晶胞结构如图所示。若 为阿伏加德罗常数的值,晶胞中最近的 之间的距离为 ,则氧化镍的密度为 。