2021年高考化学押题卷B【新课标III卷】
试卷更新日期:2021-06-02 类型:高考模拟
一、选择题:本题共7小题,每小题6分,共42分。每小题只有一个选项符合题意。
-
1. “文房四宝”是中国特有的书法、绘画工具。下列有关叙述错误的是( )A、湖笔所用“狼毫”的主要成分是蛋白质 B、徽墨的主要成分是炭黑 C、宣纸的主要成分是纤维素 D、端砚的主要成分是电石和石英2. 化合物(a)与(b)的结构简式如图所示。下列叙述正确的是( )
 A、(a)与(b)互为同分异构体 B、(a)分子中所有碳原子均共面 C、(b)的一氯取代物共有3种 D、(a)与(b)均能使Br2/CCl4 褪色3. 设NA表示阿伏加德罗常数的值。下列叙述错误的是( )A、标准状况下,1 mol Fe在22.4 L Cl2中完全燃烧时转移电子数为3NA B、6.5gNaN3中含有的阴离子数目为0.1NA C、常温下,0.1 mol环丙烷中含有的共价键数为0.9NA D、1 L 0.1 mol·L-1 Na2S溶液中S2-数目与HS-数目之和小于0.1NA4. 下列实验操作或仪器的使用正确的是( )A、
A、(a)与(b)互为同分异构体 B、(a)分子中所有碳原子均共面 C、(b)的一氯取代物共有3种 D、(a)与(b)均能使Br2/CCl4 褪色3. 设NA表示阿伏加德罗常数的值。下列叙述错误的是( )A、标准状况下,1 mol Fe在22.4 L Cl2中完全燃烧时转移电子数为3NA B、6.5gNaN3中含有的阴离子数目为0.1NA C、常温下,0.1 mol环丙烷中含有的共价键数为0.9NA D、1 L 0.1 mol·L-1 Na2S溶液中S2-数目与HS-数目之和小于0.1NA4. 下列实验操作或仪器的使用正确的是( )A、 B、
B、 C、
C、 D、
D、 5. 下列离子方程式正确的是( )A、向NaClO和NaCl混合溶液中滴入少量FeSO4溶液,反应的离子方程式为:
5. 下列离子方程式正确的是( )A、向NaClO和NaCl混合溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+ =Cl-+2Fe3++H2O
B、水玻璃长时间放置在空气中变浑浊:SiO +2CO2+2H2O= H2SiO3↓+2HCO C、H218O2中加入H2SO4酸化的KMnO4:5H218O2+2MnO +6H+ =518O2↑+2Mn2++8H2O D、Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO +2OH- =CaCO3↓+CO +2H2O6. 如图为某二次电池充电时的工作原理示意图,该过程可实现盐溶液的淡化。下列说法正确的是( ) A、充电时,a极为电源负极 B、充电时,电解质溶液的pH不变 C、放电时,每生成1 mol Bi消耗1.5 mol D、放电时,负极反应式为7. X、Y、Z、M、Q五种短周期主族元素,原子序数依次增大。元素X、Y、Q的单质在常温下呈气态,元素Y的最高正价和最低负价之和为2,元素Z在同周期的主族元素中原子半径最大,元素M是地壳中含量最多的金属元素。下列说法错误的是( )A、元素X、Y可以形成离子化合物 B、简单离子半径:Y < Z C、元素Z、M的最高价氧化物对应的水化物能相互反应 D、M、Q两种元素形成的化合物的水溶液呈酸性
A、充电时,a极为电源负极 B、充电时,电解质溶液的pH不变 C、放电时,每生成1 mol Bi消耗1.5 mol D、放电时,负极反应式为7. X、Y、Z、M、Q五种短周期主族元素,原子序数依次增大。元素X、Y、Q的单质在常温下呈气态,元素Y的最高正价和最低负价之和为2,元素Z在同周期的主族元素中原子半径最大,元素M是地壳中含量最多的金属元素。下列说法错误的是( )A、元素X、Y可以形成离子化合物 B、简单离子半径:Y < Z C、元素Z、M的最高价氧化物对应的水化物能相互反应 D、M、Q两种元素形成的化合物的水溶液呈酸性二、非选择题:必考题
-
8. 氮化锶( )在工业上广泛应用于生产荧光粉。已知锶和镁位于同主族且锶比镁活泼,锶与氮气在加热条件下反应产生氮化锶,氮化锶遇水剧烈反应。某学习小组拟设计两套方案制备氮化锶并测定产品的纯度。(1)、方案I:根据下列装置制备氮化锶:
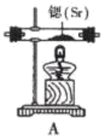
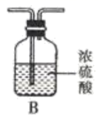


已知:实验室用饱和氯化铵溶液和亚硝酸钠溶液共热制备氮气。回答下列问题:
气流从左至右,选择装置并排序为 (用字母表示)。
(2)、写出实验室制备N2的化学方程式。(3)、实验时先点燃处酒精灯(填“A”或“D”),一段时间后,点燃另一只酒精灯。(4)、方案II:某氮气样品可能含有少量的CO、CO2、O2等气体杂质,某同学设计如下装置制备氮化锶(各装置盛装足量试剂)。已知:醋酸二氨合亚铜 溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力;连苯三酚碱性溶液能定量吸收O2。
试管II、III、IV盛装的试剂分别是(填标号),装置Ⅵ的作用是。
a.连苯三酚碱性溶液 b.浓硫酸 c.醋酸二氨合亚铜溶液
测定产品纯度:称取9.0g方案II中所得产品,加入干燥的三颈瓶中,然后由恒压漏斗加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用 的盐酸标准溶液完全吸收(吸收液体体积变化忽略不计)。从烧杯中量取 的吸收液,用 标准溶液滴定过剩的HCl,到终点时消耗 溶液(图中夹持装置略)
 (5)、用 标准溶液滴定过剩的盐酸时所选指示剂为(填标号)。
(5)、用 标准溶液滴定过剩的盐酸时所选指示剂为(填标号)。a.石蕊试液 b.甲基橙 c.酚酞试液
(6)、产品纯度为%(保留一位小数)。(7)、下列实验操作可能使氮化锶( )测定结果偏低的是(填标号)。a.锥形瓶洗涤干净后未干燥,直接装入待测液
b.滴定时未用 标准溶液润洗滴定管
c.滴定前滴定管尖嘴处有气泡,滴定结束后气泡消失
d.读数时,滴定前平视,滴定后俯视
9. 钯( )是一种不活泼金属,含钯催化剂在工业、科研上用量较大。某废钯催化剂(钯碳)中含有钯(5%~6%)、碳(93%~94%)、铁(1%~2%)以及其他杂质,故钯碳具有很高的回收价值。如图是利用钯碳制备氯化钯( )和 的流程。
回答下列问题:
(1)、“钯碳”焚烧过程中空气一定要过量,目的是。(2)、“钯灰”中的主要成分有 ,加入甲酸( ),可以将 还原成金属单质,请写出 还原 的化学方程式。(3)、王水是按照体积比3:1将浓盐酸和浓硝酸混合而得到的强氧化性溶液,加热条件下钯在王水中发生反应生成 和一种有毒的无色气体A,该气体遇空气变红棕色,请写出 和王水反应的化学方程式。(4)、加入浓氨水,调节 至9.0,并控制温度在70~75℃, 元素以 的形式存在于溶液中。若温度大于75℃,则不利于除铁,原因是;。(5)、黄色晶体的成分为 ,将其烘干、在空气中550℃下焙烧(氧气不参与反应)可以直接得到 ,同时得到无色刺激性混合气体,在温度下降时“冒白烟”,则除 外其他产物有(写化学式)。(6)、海绵状金属钯密度为 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R= ,氢气的浓度r=。(吸附容量R即 钯吸附氢气的体积;氢气的浓度r为 吸附氢气的物质的量)10. 羰基硫(O=C=S)广泛存在于以煤为原料制备的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染等。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:①氢解反应:
②水解反应:
请回答下列问题:
(1)、根据上述信息,CO(g)+,H-2.O(g)⇌,H-2.(g)+,CO-2.(g) 。(2)、某温度时,在恒容密闭容器中用活性 作催化剂发生羰基硫(COS)的水解反应,COS(g)的平衡转化率随不同投料比 的转化关系如图1所示。其他条件相同时,改变反应温度,测得反应时间为ts时COS的水解转化率如图2所示。
①反应时间为 时,该水解反应的最佳反应条件为投料比 , 温度为。
②当温度升高到一定值后,发现反应时间为ts时COS(g)的水解转化率降低,猜测可能的原因是(写出两条即可)。
(3)、羰基硫(COS)的氢解反应的正、逆反应的平衡常数(K)与温度(T)的关系如图3所示,其中表示逆反应的平衡常数( )变化曲线的是(填“A”或“B”)。 时,向容积为10L的恒容密闭容器中充入 和 ,发生COS的氢解反应,则该温度下COS的平衡转化率为。(4)、COS氢解反应产生的CO可合成二甲醚( ),二甲醚燃料电池的工作原理如图4所示。
①该电池的负极反应式为。
②若利用该燃料电池电解硫酸钠溶液,消耗4.6g二甲醚后,在电解池两极共收集到13.44L(标准状况)气体,则该燃料电池装置的能量利用率为(结果保留3位有效数字)。
三、选考题
-
11. 氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂(主要成分Na2B4O7)为起始物,经过一系列反应可以得到BN和火箭高能燃料及有机合成催化剂BF3的过程如下:(1)、BF3中B原子的杂化轨道类型为 , BF3分子空间构型为;(2)、在硼、氧、氟、氮中第一电离能由大到小的顺序是(用元素符号表示);(3)、已知硼酸的电离方程式为H3B03+H2O⇌[B(OH)4]﹣+H+ , 试依据上述反应判断[Al(OH)4]﹣的中存在下列哪些键;
a.共价键 b.非极性键 c.配位键 d.σ键 e.π键
并写出结构式 , 及推测1mol NH4BF4(氟硼酸铵)中含有个配位键.
(4)、氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性 (晶体结构如图)。
①关于这两种晶体的说法,错误的是(填字母);
a.两种晶体均为分子晶体 b.两种晶体中的B﹣N键均为共价键
c.六方相氮化硼层间作用力小,所以质地软 d.立方相氮化硼含有σ键和π键,所以硬度大
②六方相氮化硼晶体内B﹣N键数与硼原子数之比为 , 其结构与石墨相似却不导电,原因是;
③立方相氮化硼晶体中,每个硼原子连接个六元环。
12. 一种重要的降血糖药物M( )的合成路线如下(略去部分反应条件):
)的合成路线如下(略去部分反应条件): 
已知:


回答下列问题:
(1)、B的名称为 , F的结构简式为。(2)、反应②的反应类型为。(3)、下列关于上述涉及的有机物的说法正确的是(填标号)。a.化合物E能使酸性高锰酸钾溶液褪色
b.化合物F既能与盐酸反应,又能与 溶液反应
c.M中含氧官能团的名称为酯基、酮基
(4)、写出 的化学方程式。(5)、由G可制得物质I( ),写出满足下列条件的I的同分异构体的结构简式。
),写出满足下列条件的I的同分异构体的结构简式。 ①能与 溶液发生显色反应
②除苯环外不含其他环
③ 谱中峰面积之比为
(6)、请设计以G为原料合成H的合理路线流程图(无机试剂任选)。