2021年高考化学押题卷A【新课标III卷】
试卷更新日期:2021-06-02 类型:高考模拟
一、选择题:本题共7小题,每小题6分,共42分。每小题只有一个选项符合题意。
-
1. 2020年11月24日,嫦娥五号探测器发射圆满成功,开启我国首次地外天体采样返回之旅。探月工程所选用的新材料与化学有密切相关。下列叙述正确的是( )A、登月中,所用北斗系统的导航卫星,其计算机的芯片材料是高纯度二氧化硅 B、用于光学望远镜的高致密碳化硅特种陶瓷材料,是一种传统无机非金属材料 C、面对高空低压的环境,所使用的碳纤维是一种有机高分子材料 D、嫦娥五号探测器在月球表面展示的国旗,其材料要求具有耐高低温、防静电等多种特性,所用的高性能芳纶纤维材料是复合材料
-
2. 家用液化气的主要成分为丙烷、丙烯、丁烷和丁烯,下列说法错误的是( )A、丙烯和丁烯均能发生加成反应 B、可用溴水来鉴别丙烷与丙烯 C、丁烷中所有原子不可能处于同一平面 D、丙烷的二氯代物有3种
-
3. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,22.4LSO3中含有的分子数约为1NA B、1mol白磷P4固体所含共价键数目为4NA C、78gNa2O2晶体所含离子的微粒数为3NA D、常温常压下,22.4L氯气溶于水,转移电子数为1NA
-
4. 实验是化学研究的基础,下列关于各实验装置图(部分夹持装置省略)的叙述错误的是( )
 A、利用装置①可除去粗溴苯(溴苯沸点为156.2℃)中混有的苯(沸点为80.1℃) B、利用装置②及相关实验现象可推知酸性: C、利用装置③,由b口进气可收集 、 D、利用装置④可制备二氧化硫气体
A、利用装置①可除去粗溴苯(溴苯沸点为156.2℃)中混有的苯(沸点为80.1℃) B、利用装置②及相关实验现象可推知酸性: C、利用装置③,由b口进气可收集 、 D、利用装置④可制备二氧化硫气体 -
5. 下列离子方程式正确的是是( )A、用 从酸化的海带灰浸出液中提取碘: B、向碳酸氢铵溶液中加入过量的 NaOH溶液: C、向饱和的碳酸钠溶液中通入足量的二氧化碳: D、过量 SO2通入 NaClO溶液中:
-
6. 某工厂用NaCl为原料制备高氯酸,实验按流程如下所示,下列说法错误的是( )
 A、电解Ⅰ分别用不锈钢网和石墨作电极,石墨电极上有黄绿色气体生成 B、“60℃歧化”的反应为:3Cl2+3CO32-=5Cl−+ClO3-+3CO2 C、电解Ⅱ中阳极反应式为:ClO3-+2OH−-2e−=ClO4-+H2O D、循环利用物质A的成分是NaCl、NaClO4
A、电解Ⅰ分别用不锈钢网和石墨作电极,石墨电极上有黄绿色气体生成 B、“60℃歧化”的反应为:3Cl2+3CO32-=5Cl−+ClO3-+3CO2 C、电解Ⅱ中阳极反应式为:ClO3-+2OH−-2e−=ClO4-+H2O D、循环利用物质A的成分是NaCl、NaClO4 -
7. 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的化合物Z2T能破坏水的电离平衡。下列推断正确的是( )
 A、原子半径和离子半径均满足:Y<Z B、最高价氧化物对应水化物的酸性:T<R C、氢化物的沸点不一定是:Y>R D、由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性
A、原子半径和离子半径均满足:Y<Z B、最高价氧化物对应水化物的酸性:T<R C、氢化物的沸点不一定是:Y>R D、由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性
二、非选择题:必考题
-
8. 著名化学反应“法老之蛇”曾令无数人叹服。某兴趣小组为探究Hg(SCN)2分解产物的成分,在连接好如图所示装置,检验装置气密性后,点燃A处酒精灯。
已知:Ksp(HgS)=4.0×10-5。
(CN)2
沸点为-21.2℃,熔点为-34.4 ℃,化学性质与卤素单质相似,有剧毒,燃烧时火焰星紫红色,边缘略带蓝色
CS2
沸点为 46. 5℃,熔点为-111.9℃,能与酯互溶

回答下列问题:
(1)、仪器a的名称为。(2)、已知Hg(SCN)2微溶于水,可由KSCN溶液与Hg(NO3)2溶液反应制得,若以Fe3+作指示剂,则当溶液变为色时,Hg2+沉淀完全。(3)、待A中固体充分分解后,取下B装置,B瓶中有无色液体,并有类似氯仿的芳香甜味,与酯混合能够互溶,经查证,B中液体为CS2 , CS2可用于制造人造丝、杀虫剂,请举出一种其在实验室中的用途。(4)、取下C装置,点燃C中气体,气体燃烧火焰呈紫红色,边缘略带蓝色,则E中反应的化学方程式为。(5)、取下D装置,将燃着的镁条伸入瓶中,镁条会继续燃烧,取出燃烧产物,加入少量热水,产生的气体能使湿润的红色石蕊试纸变蓝,则证明Hg(SCN)2分解产物中含有。(6)、取出A中剩余固体,加水溶解,固体不溶,加入王水固体溶解,则证明含有HgS。记溶解后的溶液为X。该固体(填“能”或“不能")溶于稀盐酸,原因是。(7)、经上述推断,写出Hg(SCN)2分解的化学方程式。(8)、若要测定Hg(SCN)2的分解率,可用NH4SCN滴定法测定溶液X中离子浓度。已知:①3HgS+2HNO3+12HCl=3H2[HgCl4]+3S↓+2NO↑+4H2O;
②H2[HgCl4]+2SCN-=Hg(SCN)2↓+4Cl-+2H+;
③NH4SCN标准溶液中含有NH4Fe(SO4)2指示液。
若取上述溶液X,用浓度为c mol/L的NH4SCN标准溶液进行滴定,消耗V mL,忽略反应前后溶液体积变化,原Hg(SCN)2固体质量为m g,滴定终点的现象为 , Hg(SCN)2的分解率为。
-
9. CoCO3是一种制造锂电池电极的原料。以含钴废渣(主要成分CoO、Co2O3 , 还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
金属离子
开始沉淀的pH
沉淀完全的pH
Co2+
7.6
9.4
Al3+
3.0
5.0
Zn2+
5.4
8.0
(1)、“酸浸”时通入SO2发生反应的离子方程式是。(2)、“除铝”时调节溶液pH范围为 , 该过程中主要反应的离子方程式为。(3)、“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是。(4)、“沉钴”时为使Co2+沉淀完全,Na2CO3溶液需稍过量且缓慢滴加,能说明Co2+已沉淀完全的实验操作是。(5)、CoCO3隔绝空气灼烧可以生成Co2O3 , 该反应的化学方程式为。(6)、某工业生产过程中得到溶液的溶质主要是ZnSO4和CuSO4。已知硫酸锌晶体的溶解度随温度变化如图,请设计从该混合液中获取ZnSO4晶体的实验方案:
向溶液中加入稍过量的锌粉,充分反应后, , 得到ZnSO4溶液, , 得到ZnSO4晶体。(实验中须使用的试剂有:Zn粉、稀H2SO4、酒精)。
-
10. CO2甲烷化在解决环境和能源问题等方面具有重要意义。已知CO2甲烷化包含如下反应:
主反应: △H
副反应: △H1 =+41 kJ·mol-1
△H2=-172kJ·mol -1
△H3=-75kJ·mol-1
(1)、主反应的△H= , 该反应可在(填“较低温度”、“较高温度”或“任何温度”)下自发进行。(2)、在某高效催化剂的作用下,副反应的影响可忽略不计。将1 mol CO2、4mol H2通入容积为2L的恒容密闭容器中,200℃时容器内CO2的物质的量随时间的变化如下表所示:时间/min-1
10
20
30
40
50
60
n(CO2)mol
0.31
0.53
0.40
0.30
0.25
0.25
①能说明反应已达平衡状态的是(填标号)
a.c(CO2):c(H2O)=1:6 b.混合气体的密度不变 c.v正(H2)=4v逆(CH4) d.密闭容器内压强不变
②40min内,消耗H2的平均反应速率为。
③反应达到平衡时CO2的转化率为。
(3)、我国科学家研究了在两种不同催化剂Ni(lll)、Ni—La表面上CO2甲烷化的反应历程,如图所示(截取部分图),其中吸附在催化剂表面上的物种用*标注。
由图中反应历程与能量变化可知:使用催化剂更有利于CO2的吸附。反应能垒(活化能)最(填“高”或“低”)的步骤为整个反应的速控步骤,写出以Ni(lll)为催化剂的速控步骤的化学方程式。两种催化剂催化反应的速控步骤(填“相同”或“不相同”)。
三、选考题
-
11. 硫及其化合物有许多用途,请回答下列问题。(1)、基态硫原子的价电子排布式为 , 其电子占据最高能级的电子云轮廓图形状为;(2)、常见含硫的物质有单质硫(S8)、SO2、Na2S、K2S等,四种物质的熔点由高到低的顺序依次为 , 原因是。(3)、炼铜原料黄铜矿中铜的主要存在形式是CuFeS2 , 煅烧黄铜矿生成SO2 , CuFeS2中存在的化学键类型是 , SO2中心原子的价层电子对数为。(4)、方铅矿(即硫化铅)是一种比较常见的矿物,酸溶反应为:PbS+4HCl(浓)= H2[PbCl4]+H2S↑。H2S分子属于(填“极性”或“非极性”)分子,其中心原子的杂化方式为。下列分子的空间构型与H2S相同的有;
A.H2O B.CO2 C.SO2 D.CH4
(5)、方铅矿的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的空隙中。已知晶体密度为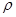 g•cm-3 , 阿伏加德罗常数的值为NA , 则晶胞中硫离子与铅离子最近的距离为nm
g•cm-3 , 阿伏加德罗常数的值为NA , 则晶胞中硫离子与铅离子最近的距离为nm 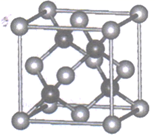
-
12. G是药物合成的中间体,其部分合成路线如下:

已知:RCHO + CH3COR1 RCH=CHCOR1 + H2O
请回答下列问题:
(1)、C→D的反应类型为。(2)、试剂E的名称为 , G的分子式为。(3)、写出A→B的化学方程式。(4)、设计A→B步骤的目的是。(5)、芳香族化合物T是D的同分异构体,满足下列条件的结构一共有种。①能发生银镜反应;
②遇FeCl3溶液不发生显色反应,其在稀硫酸中的水解产物之一遇FeCl3溶液能发生显色反应;
③在核磁共振氢谱上有七组峰;
(6)、以环己醇和 为原料,写出合成
为原料,写出合成  的路线。
的路线。
