新疆昌吉教育共同体2020-2021学年高一下学期化学期中考试试卷
试卷更新日期:2021-06-01 类型:期中考试
一、单选题
-
1. 对发现元素周期律贡献最大的化学家是( )A、牛顿 B、道尔顿 C、阿伏加德罗 D、门捷列夫2. 在下列元素中,最高正化合价数值最大的是( )A、Na B、P C、Cl D、Ar3. 下列说法正确的是( )A、含有离子键的化合物必是离子化合物 B、含有共价键的化合物就是共价化合物 C、共价化合物可能含离子键 D、离子化合物中不可能含有共价键4. 有关化学用语正确的是( )A、HF的电子式:H+
 B、NaCl的电子式:
B、NaCl的电子式:  C、Cl-的结构示意图:
C、Cl-的结构示意图:  D、氮气分子的结构式:N ≡N
5. 我国成功研发出133Cs原子钟,使我国时间频率基准的精度从30万年不差一秒提高到600万年不差一秒,标志着我国在此领域进入世界先进行列,已知133Cs的质子数为55。下列说法正确的是( )A、133Cs的核电荷数为133 B、133Cs的核电荷数为55 C、133Cs的中子数为55 D、铯与水的反应比钠与水的反应更缓慢6. 下图各装置中,不能构成原电池的是(烧杯中所盛液体都是稀硫酸)( )A、
D、氮气分子的结构式:N ≡N
5. 我国成功研发出133Cs原子钟,使我国时间频率基准的精度从30万年不差一秒提高到600万年不差一秒,标志着我国在此领域进入世界先进行列,已知133Cs的质子数为55。下列说法正确的是( )A、133Cs的核电荷数为133 B、133Cs的核电荷数为55 C、133Cs的中子数为55 D、铯与水的反应比钠与水的反应更缓慢6. 下图各装置中,不能构成原电池的是(烧杯中所盛液体都是稀硫酸)( )A、 B、
B、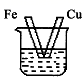 C、
C、 D、
D、 7. 短周期元素X、Y、Z、W在元素周期表的相对位置如图所示,其中W元素原子的质子数是其最外层电子数的3倍,下列说法错误的( )
7. 短周期元素X、Y、Z、W在元素周期表的相对位置如图所示,其中W元素原子的质子数是其最外层电子数的3倍,下列说法错误的( ) A、Z的单质常用于制造光导纤维 B、简单氢化物的沸点:Y>X C、X、Z、W的常见单质在一定条件下都可以与Y的常见单质反应 D、元素X、Z、W的最高化合价分别与其主族序数相等8. 关于现行的元素周期表的说法正确的是( )A、元素周期表有8个主族 B、元素周期表有7个周期 C、短周期是指第一、二周期 D、IA族的元素全部是金属元素9. 将2 mol X和2 mol Y充入2 L密闭容器中发生如下反应:X(g)+3Y(g)⇌2Z(g)+aQ(g)。2min后达到平衡时生成0.8 molZ,测得Q的浓度为0.4 mol/L,下列叙述错误的是( )A、a的值为2 B、平衡时X的浓度为0.8 mol·L-1 C、Y的转化率为60% D、反应速率υ(Y)=0.6 mol·(L·min)-110. 下列递变规律正确的是( )A、O,S,Na、K的原子半径依次增大 B、Na、Mg、Al、Si的金属性逐渐增强 C、HF,HCl、H2S,PH3的稳定性依次增强 D、KOH,Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强11. 下列反应中属吸热反应的是( )A、镁与盐酸反应放出氢气 B、氢氧化钠与盐酸的反应 C、硫在空气或氧气中燃烧 D、Ba(OH)2·8H2O与NH4Cl反应12. 有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A→B;当A、D组成原电池时,A为正极;B与C构成原电池时,电极反应式为:C2-+2e-→C,B-2e-→B2+则A、B、C、D金属性由强到弱的顺序为( )A、A>B>C>D B、A>B>D>C C、D>C>A>B D、D>A>B>C13. 关于化学反应的说法错误的是( )
A、Z的单质常用于制造光导纤维 B、简单氢化物的沸点:Y>X C、X、Z、W的常见单质在一定条件下都可以与Y的常见单质反应 D、元素X、Z、W的最高化合价分别与其主族序数相等8. 关于现行的元素周期表的说法正确的是( )A、元素周期表有8个主族 B、元素周期表有7个周期 C、短周期是指第一、二周期 D、IA族的元素全部是金属元素9. 将2 mol X和2 mol Y充入2 L密闭容器中发生如下反应:X(g)+3Y(g)⇌2Z(g)+aQ(g)。2min后达到平衡时生成0.8 molZ,测得Q的浓度为0.4 mol/L,下列叙述错误的是( )A、a的值为2 B、平衡时X的浓度为0.8 mol·L-1 C、Y的转化率为60% D、反应速率υ(Y)=0.6 mol·(L·min)-110. 下列递变规律正确的是( )A、O,S,Na、K的原子半径依次增大 B、Na、Mg、Al、Si的金属性逐渐增强 C、HF,HCl、H2S,PH3的稳定性依次增强 D、KOH,Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强11. 下列反应中属吸热反应的是( )A、镁与盐酸反应放出氢气 B、氢氧化钠与盐酸的反应 C、硫在空气或氧气中燃烧 D、Ba(OH)2·8H2O与NH4Cl反应12. 有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A→B;当A、D组成原电池时,A为正极;B与C构成原电池时,电极反应式为:C2-+2e-→C,B-2e-→B2+则A、B、C、D金属性由强到弱的顺序为( )A、A>B>C>D B、A>B>D>C C、D>C>A>B D、D>A>B>C13. 关于化学反应的说法错误的是( ) A、如图所示的反应为放热反应 B、化学反应中有物质变化也有能量变化 C、需要加热的化学反应不一定是吸热反应 D、化学键断裂吸收能量,化学键形成放出能量14. 下列有关化学反应速率和限度的说法中,错误的是( )A、实验室用H2O2分解制O2 , 加入MnO2后,反应速率明显加快 B、在金属钠与足量水反应中,增加水的量能加快反应速率 C、2SO2+O2 2SO3反应中,SO2的转化率不能达到100% D、实验室用碳酸钙和盐酸反应制取CO2 , 用粉末状碳酸钙比块状反应要快15. 甲、乙两种非金属:①甲比乙容易与H2化合;②甲单质能与乙阴离子发生置换反应;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲单质的熔、沸点比乙的低。能说明甲比乙的非金属性强的是 ( )A、只有④ B、只有⑤ C、①②③ D、①②③④⑤16. “神舟七号”的燃料是氢化锂三兄弟:LiH、LiD、LiT。其中Li的质量数为7,则对相同物质的量的这三种物质的下列说法正确的是( )A、质子数之比为1∶2∶3 B、中子数之比为1∶1∶1 C、摩尔质量之比为8∶9∶10 D、化学性质不相同17. 把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由如图2-1-1表示,在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的因素是( )。
A、如图所示的反应为放热反应 B、化学反应中有物质变化也有能量变化 C、需要加热的化学反应不一定是吸热反应 D、化学键断裂吸收能量,化学键形成放出能量14. 下列有关化学反应速率和限度的说法中,错误的是( )A、实验室用H2O2分解制O2 , 加入MnO2后,反应速率明显加快 B、在金属钠与足量水反应中,增加水的量能加快反应速率 C、2SO2+O2 2SO3反应中,SO2的转化率不能达到100% D、实验室用碳酸钙和盐酸反应制取CO2 , 用粉末状碳酸钙比块状反应要快15. 甲、乙两种非金属:①甲比乙容易与H2化合;②甲单质能与乙阴离子发生置换反应;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲单质的熔、沸点比乙的低。能说明甲比乙的非金属性强的是 ( )A、只有④ B、只有⑤ C、①②③ D、①②③④⑤16. “神舟七号”的燃料是氢化锂三兄弟:LiH、LiD、LiT。其中Li的质量数为7,则对相同物质的量的这三种物质的下列说法正确的是( )A、质子数之比为1∶2∶3 B、中子数之比为1∶1∶1 C、摩尔质量之比为8∶9∶10 D、化学性质不相同17. 把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由如图2-1-1表示,在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的因素是( )。 A、①④ B、①②③ C、③④ D、②③18. 已知破坏1molH-H键、Cl-Cl键、H-Cl键分别需要吸收436kJ、243kJ、432kJ能量,则由H2与Cl2生成1 molHCl总的过程需要( )A、放热185kJ B、吸热185kJ C、放热92.5 kJ D、吸热92.5 kJ19. 氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应如下:2H2+4OH--4e-=4H2O、O2+2H2O+4e-=4OH- , 下列说法错误的是( )A、氢气通入正极,氧气通入负极 B、燃料电池的能量转化率不能达到100% C、供电时的总反应为:2H2+O2= 2H2O D、产物为无污染的水,属于环境友好电池20. 可逆反应A(g)+ 2B(g) C(g)+ D(g) ,在四种不同情况下的反应速率如下,其中反应进行得最快的是( )A、VA=0.15mol/L·min B、VB=0.6 mol/L·min C、VC=0.4 mol/L·min D、VD=0.1mol/L·min21. 未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是( )
A、①④ B、①②③ C、③④ D、②③18. 已知破坏1molH-H键、Cl-Cl键、H-Cl键分别需要吸收436kJ、243kJ、432kJ能量,则由H2与Cl2生成1 molHCl总的过程需要( )A、放热185kJ B、吸热185kJ C、放热92.5 kJ D、吸热92.5 kJ19. 氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应如下:2H2+4OH--4e-=4H2O、O2+2H2O+4e-=4OH- , 下列说法错误的是( )A、氢气通入正极,氧气通入负极 B、燃料电池的能量转化率不能达到100% C、供电时的总反应为:2H2+O2= 2H2O D、产物为无污染的水,属于环境友好电池20. 可逆反应A(g)+ 2B(g) C(g)+ D(g) ,在四种不同情况下的反应速率如下,其中反应进行得最快的是( )A、VA=0.15mol/L·min B、VB=0.6 mol/L·min C、VC=0.4 mol/L·min D、VD=0.1mol/L·min21. 未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是( )①天然气 ②煤 ③石油 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能
A、①②③④ B、④⑤⑥⑦ C、③⑤⑥⑦ D、③④⑤⑥⑦22. 等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中滴入少量的CuSO4溶液,如图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )A、 B、
B、 C、
C、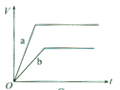 D、
D、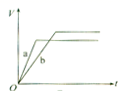 23. 已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的( )A、质子数:c>d B、离子的还原性:Y2->Z- C、氢化物的稳定性:H2Y>HZ D、原子半径:X<W24. 将一定量的SO2和氧气放入一定体积的密容器中,550℃时在催化剂作用下发生反应:2SO2(g)+O2(g) 2SO3(g) (正反应放热)。下列能判断该反应达到平衡状态的标志是( )A、容器中混合气体的密度保持不变 B、每消耗1molO2的同时生成1molSO3 C、容器中气体的压强不变 D、SO3的生成速率与SO2的消耗速率相等25. 下列关于四种装置的叙述错误的是( )
23. 已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的( )A、质子数:c>d B、离子的还原性:Y2->Z- C、氢化物的稳定性:H2Y>HZ D、原子半径:X<W24. 将一定量的SO2和氧气放入一定体积的密容器中,550℃时在催化剂作用下发生反应:2SO2(g)+O2(g) 2SO3(g) (正反应放热)。下列能判断该反应达到平衡状态的标志是( )A、容器中混合气体的密度保持不变 B、每消耗1molO2的同时生成1molSO3 C、容器中气体的压强不变 D、SO3的生成速率与SO2的消耗速率相等25. 下列关于四种装置的叙述错误的是( )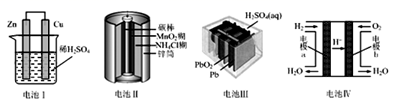 A、电池Ⅰ:正极发生的反应为2H++2e﹣═H2↑ B、电池Ⅱ:锌筒做负极,发生氧化反应 C、电池Ⅲ:是最早使用的充电电池,又称为二次电池 D、电池Ⅳ:外电路中电子由电极b通过导线流向电极a
A、电池Ⅰ:正极发生的反应为2H++2e﹣═H2↑ B、电池Ⅱ:锌筒做负极,发生氧化反应 C、电池Ⅲ:是最早使用的充电电池,又称为二次电池 D、电池Ⅳ:外电路中电子由电极b通过导线流向电极a二、综合题
-
26. 给你提供纯锌、纯铜片和500 mL 0.4 mol·L-1的H2SO4溶液、导线、1000 mL量筒。试用下图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。
 (1)、如图所示,装置气密性良好,且1 000 mL量筒中已充满了水,则开始实验时,首先要。(2)、a电极材料为 , 其电极反应式为。b电极材料为 , 其电极反应式为。(3)、当量筒中收集672 mL气体时(已折算到标准状况下),通过导线的电子的物质的量为。27. 化学反应伴随着能量变化是化学反应的基本特征之一。某同学进行如下实验,以检验化学反应中的能量变化。
(1)、如图所示,装置气密性良好,且1 000 mL量筒中已充满了水,则开始实验时,首先要。(2)、a电极材料为 , 其电极反应式为。b电极材料为 , 其电极反应式为。(3)、当量筒中收集672 mL气体时(已折算到标准状况下),通过导线的电子的物质的量为。27. 化学反应伴随着能量变化是化学反应的基本特征之一。某同学进行如下实验,以检验化学反应中的能量变化。
请回答下列问题:
(1)、实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是热反应,Ba(OH)2·8H2O与NH4Cl的反应是热反应。反应过程(填“①”或“②”)的能量变化可用下图表示。 (2)、①中发生反应的离子方程式是;在该反应中,作为还原剂的物质是(填化学式)。28. 下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
(2)、①中发生反应的离子方程式是;在该反应中,作为还原剂的物质是(填化学式)。28. 下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白: (1)、在这些元素中,化学性质最不活泼的是(填具体元素符号,下同)。(2)、在最高价氧化物的水化物中,酸性最强的化合物的化学式是 , 碱性最强的化合物的化学式是。(3)、最高价氧化物是两性氧化物的元素是;写出它的氧化物与氢氧化钠反应的离子方程式。(4)、用电子式表示元素④与⑥形成的化合物: , 该化合物属于(填“共价”或“离子”)化合物。29. 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
(1)、在这些元素中,化学性质最不活泼的是(填具体元素符号,下同)。(2)、在最高价氧化物的水化物中,酸性最强的化合物的化学式是 , 碱性最强的化合物的化学式是。(3)、最高价氧化物是两性氧化物的元素是;写出它的氧化物与氢氧化钠反应的离子方程式。(4)、用电子式表示元素④与⑥形成的化合物: , 该化合物属于(填“共价”或“离子”)化合物。29. 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。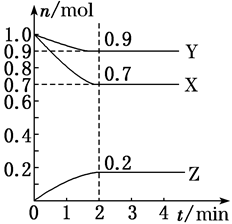 (1)、由图中所给数据进行分析,该反应的化学方程式为;(2)、反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为v(Z)=;(3)、2min反应达平衡容器内混合气体的平均相对分子质量比起始时(填增大、减小或无变化,下同);混合气体密度比起始时。(4)、将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=n (Z),则原混合气体中a:b=。(5)、下列措施能加快反应速率的是_______。A、恒压时充入He B、恒容时充入He C、恒容时充入X D、及时分离出Z E、升高温度 F、选择高效的催化剂30. 化合物A的蒸气2mol充入0.5 L容器中加热,发生分解反应2A(g)⇌B(g)+nC(g),反应到3min时达到平衡,此时容器中A的浓度为1.6mol/L,并测得这段时间内用C的浓度变化表示的平均反应速率为v(C)=1.2mol/(L·min)(1)、求化学方程式中的计量数n的值(2)、以B的浓度变化表示该反应的平均速率(3)、平衡时A的转化率是多少
(1)、由图中所给数据进行分析,该反应的化学方程式为;(2)、反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为v(Z)=;(3)、2min反应达平衡容器内混合气体的平均相对分子质量比起始时(填增大、减小或无变化,下同);混合气体密度比起始时。(4)、将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=n (Z),则原混合气体中a:b=。(5)、下列措施能加快反应速率的是_______。A、恒压时充入He B、恒容时充入He C、恒容时充入X D、及时分离出Z E、升高温度 F、选择高效的催化剂30. 化合物A的蒸气2mol充入0.5 L容器中加热,发生分解反应2A(g)⇌B(g)+nC(g),反应到3min时达到平衡,此时容器中A的浓度为1.6mol/L,并测得这段时间内用C的浓度变化表示的平均反应速率为v(C)=1.2mol/(L·min)(1)、求化学方程式中的计量数n的值(2)、以B的浓度变化表示该反应的平均速率(3)、平衡时A的转化率是多少