山西省运城市2020-2021学年高一下学期化学期中考试试卷
试卷更新日期:2021-06-01 类型:期中考试
一、单选题
-
1. 化学与生产生活密切相关,下列说法错误的是( )A、5G通信网络所用光纤光缆的主要材料是二氧化硅 B、酸雨 值小于5.6,造成酸雨的主要成分是 、 、 等 C、燃煤时加入适量石灰石,可减少废气中 的量 D、新能源汽车的推广与使用有利于减少光化学烟雾的产生2. 向 溶液中通入 气体,溶液仍然澄清;若将 溶液分别盛在甲乙两支试管中,甲试管加氯水,乙试管加氨水,然后再分别通入 气体,结果两支试管都有白色沉淀产生。下列由此得出的结论中正确的是( )A、两支试管中的白色沉淀均为 B、甲实验体现了 酸性氧化物的性质 C、乙实验体现了 的还原性 D、若将 换成 只有乙中有沉淀3. 将一包由Cu和CuO组成的混合物均分成两等份,一份混合物在加热条件下与H2充分反应,将固体全部转化成铜粉时固体质量减少了6.4g,向另一份混合物中加入500mLHNO3溶液恰好完全反应生成Cu(NO3)2和标准状况下4.48L NO (假设不产生其他还原产物)。则该混合物中Cu和CuO的物质的量之比为( )A、3∶4 B、1∶4 C、1∶3 D、2∶14. 关于下列实验的说法中正确的是( )A、实验室中通过加热氯化铵固体制取氨气 B、在胆矾中加入浓硫酸后,胆矾由蓝色变为白色,说明浓硫酸具有吸水性 C、常温下,可以用铝罐贮存浓硫酸和浓硝酸,说明铝与浓硫酸和浓硝酸不反应 D、将 样品溶于稀硫酸,滴入 溶液,溶液变红,说明原样品已变质5. 如图是利用氯化氢和氢气生产高纯硅的工艺流程。容器 中发生的反应为 ,容器 中发生的反应为 ,已知 常温下为液态。
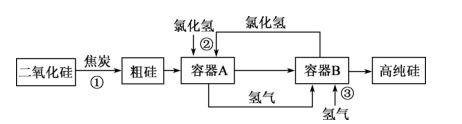
下列说法错误的是( )
A、反应①为 B、从容器B中获得高纯硅的操作为过滤 C、反应②和③中 均作氧化剂 D、该工艺中 和 可循环使用6. 下列反应既属于非氧化还原反应,又属于吸热反应的是( )A、干冰升华 B、灼热的炭与 的反应 C、铁片与稀盐酸的反应 D、 与 的反应7. 根据能量图,下列说法正确的是( ) A、 是一个吸热反应 B、 的总能量大于 和 的能量之和 C、形成 中的化学键需要放出 的能量 D、 和 的能量之和为8. 化学反应可视为旧键断裂和新键形成的过程。已知白磷和 的分子结构如图所示,现提供以下化学键的键能( ):P-P键:198,P-O键:360, 键:498,则依据反应 (白磷) ,生成1mol 时的能量变化为( )
A、 是一个吸热反应 B、 的总能量大于 和 的能量之和 C、形成 中的化学键需要放出 的能量 D、 和 的能量之和为8. 化学反应可视为旧键断裂和新键形成的过程。已知白磷和 的分子结构如图所示,现提供以下化学键的键能( ):P-P键:198,P-O键:360, 键:498,则依据反应 (白磷) ,生成1mol 时的能量变化为( )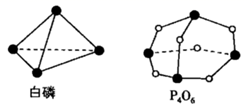 A、吸收1638kJ的能量 B、放出1638kJ的能量 C、吸收126kJ的能量 D、放出126kJ的能量9. 下列装置能构成原电池,且在铜电极上能产生大量气泡的是( )A、
A、吸收1638kJ的能量 B、放出1638kJ的能量 C、吸收126kJ的能量 D、放出126kJ的能量9. 下列装置能构成原电池,且在铜电极上能产生大量气泡的是( )A、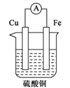 B、
B、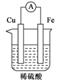 C、
C、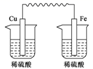 D、
D、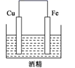 10. 一种镁燃料电池以镁片、石墨作为电极,电池反应为 。电池工作时,下列说法正确的是( )A、石墨电极反应为 B、电子由石墨经导线流向镁片 C、镁片的质量减小 D、混合溶液中 向镁片移动11. 某种氢氧燃料电池的构造如图所示。下列说法错误的是( )
10. 一种镁燃料电池以镁片、石墨作为电极,电池反应为 。电池工作时,下列说法正确的是( )A、石墨电极反应为 B、电子由石墨经导线流向镁片 C、镁片的质量减小 D、混合溶液中 向镁片移动11. 某种氢氧燃料电池的构造如图所示。下列说法错误的是( )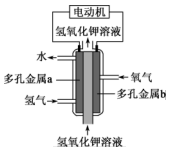 A、供电时的总反应为: B、多孔金属b作正极,是电子流入的极 C、电池工作时,电解质溶液中 移向a极 D、负极的电极反应式为12. 少量铁粉与 的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变 的产量,可以使用如下方法中的
A、供电时的总反应为: B、多孔金属b作正极,是电子流入的极 C、电池工作时,电解质溶液中 移向a极 D、负极的电极反应式为12. 少量铁粉与 的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变 的产量,可以使用如下方法中的①加 ②加 固体 ③滴入几滴浓盐酸 ④加入少量 固体 ⑤加 溶液 ⑥改用 的 ⑦升高温度(不考虑盐酸挥发) ⑧改用 硝酸( )
A、③④⑤ B、③⑥⑦ C、④⑥⑧ D、⑤⑦⑧13. 在A(g)+2B(g)⇌3C(g)+4D(g)反应中,表示该反应速率最快的是( )A、v(A)=0.3 mol/(L·s) B、v(B)=0.5 mol/(L·s) C、v(C)=0.8 mol/(L·s) D、v(D)=2.0 mol/(L·s)14. 将等物质的量的 、 混合于 的密闭容器中,发生下列反应: ,经 后测得 的浓度为 , ,以C表示的平均速率 ,下列说法错误的是( )A、反应速率 B、该反应方程式中, C、 时, 的转化率为50% D、 时, 的物质的量为15. 将一定量纯净的氨基甲酸铵固体置于密闭真空容器中(容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。可以判断该反应已经达到平衡的是( )A、2v(NH3)=v(CO2) B、容器中总压强不变 C、容器中混合气体的平均相对分子质量不变 D、容器中氨气的体积分数不变16. 一定条件下,将 气体和 固体混合于固定容积为 的密闭容器中,发生反应: 。 末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )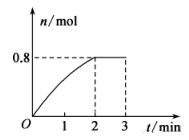 A、当混合气体的密度不再改变时,该反应不一定达到平衡状态 B、 后,加压会使正反应速率加快,逆反应速率变慢。 C、从 开始, D、反应过程中A和B的转化率之比为1∶1
A、当混合气体的密度不再改变时,该反应不一定达到平衡状态 B、 后,加压会使正反应速率加快,逆反应速率变慢。 C、从 开始, D、反应过程中A和B的转化率之比为1∶1二、综合题
-
17. 利用石灰石和烟气中的 反应生成石膏,可实现烟气中脱除 。某研究性学习小组在实验室利用如图所示装置制备烟气(主要成分为 、 、 、 ),并测定烟气中 的体积分数以及研究烟气通过转化器的脱硫效率。请回答下列问题:
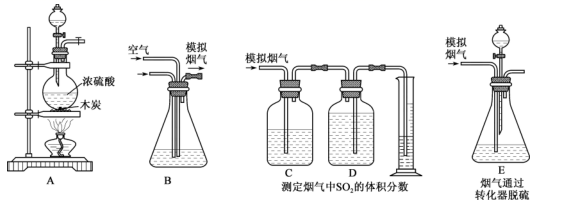 (1)、I.模拟烟气的制备。
(1)、I.模拟烟气的制备。装置A中发生反应的化学方程式:。
(2)、II.测定烟气中 的体积分数。将A中产生的气体与空气一起通过B装置混合均匀,从而形成模拟烟气。将部分模拟烟气缓慢通过C、D装置,其中C、D中盛有的药品分别是、。(填序号)
a. 溶液 b.饱和 溶液
c.饱和 溶液 d.饱和 溶液
装置C的作用是:。
(3)、①甲同学认为测定烟气中 的体积分数的装置中存在缺陷,你觉得应如何改进。②乙同学根据模拟烟气的流速 和 后测得的量筒内液体的体积 ,计算烟气中二氧化硫的体积分数是。
(4)、Ⅲ.模拟烟气通过转化器的脱硫效率研究。E中溶液可以催化 与 的反应生成 ,以达到脱硫的目的。若模拟烟气仍以 的流速通过转化器 装置, 后,向E装置中加入酸化的 溶液,得到白色浑浊液,经过滤、洗涤、干燥、称量,得到mg固体。若实验测得的气体体积已折算为标准状况下的体积,则该转化器的脱硫效率是。
18. 工业上用 生产燃料甲醇,一定条件下发生反应: ,反应过程中的能量变化情况如图所示。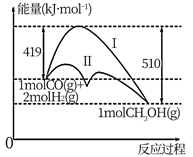 (1)、曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。该反应是(填“吸热”或“放热”)反应。计算当反应生成 时,能量变化值是kJ。(2)、选择适宜的催化剂(填“能”或“不能”)改变该反应的热量变化值。(3)、推测反应 是(填“吸热”或“放热”)反应。(4)、断开 键、 键、 键分别需要吸收能量为 、 、 ,则 与足量 反应生成 需(填“吸收”或“放出”)能量kJ。事实上,反应的热量总小于理论值,理由是。19. 人们应用原电池原理制作了多种电池,以满足不同的需要。请根据题中提供的信息,填写空格。(1)、 溶液常用于腐蚀印刷电路铜板,发生 ,若将此反应设计成原电池,则负极所用电极材料为(填化学式):;当线路中转移0.2mol电子时,则被腐蚀铜的质量为:g。(2)、锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质 ,溶于混合有机溶剂中, 通过电解质迁移入 晶格中,生成 。
(1)、曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。该反应是(填“吸热”或“放热”)反应。计算当反应生成 时,能量变化值是kJ。(2)、选择适宜的催化剂(填“能”或“不能”)改变该反应的热量变化值。(3)、推测反应 是(填“吸热”或“放热”)反应。(4)、断开 键、 键、 键分别需要吸收能量为 、 、 ,则 与足量 反应生成 需(填“吸收”或“放出”)能量kJ。事实上,反应的热量总小于理论值,理由是。19. 人们应用原电池原理制作了多种电池,以满足不同的需要。请根据题中提供的信息,填写空格。(1)、 溶液常用于腐蚀印刷电路铜板,发生 ,若将此反应设计成原电池,则负极所用电极材料为(填化学式):;当线路中转移0.2mol电子时,则被腐蚀铜的质量为:g。(2)、锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质 ,溶于混合有机溶剂中, 通过电解质迁移入 晶格中,生成 。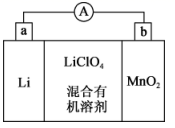
①外电路的电流方向是由极流向极(填字母)。
②电池正极反应式为。
③是否可用水代替电池中的混合有机溶剂?(填“是”或“否”),原因是。
(3)、近几年开发的甲烷—氧气燃料电池采用铂作电极催化剂,用KOH作为电池中的电解液。则通入CH4的电极为极(填“正”或“负”),通入O2的电极反应为。20. 化学反应速率和限度与生产、生活密切相关。(1)、用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:①实验过程如图所示,分析判断段化学反应速率最快。
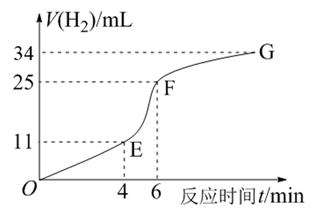
②将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其原因是。
(2)、某温度时,在2L恒容容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。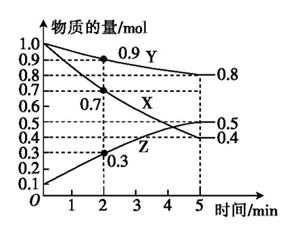
①由图中的数据分析,该反应的化学方程式为:。
②反应开始至2min时,Z的平均反应速率为。
③5min后Z的生成速率(填“大于”“小于”或“等于”)10min后Z的生成速率。
④5min时X的转化率为。
⑤5min时容器内的压强与反应前容器内的压强之比是。