山西省柳林县2020-2021学年高一下学期化学期中考试试卷
试卷更新日期:2021-06-01 类型:期中考试
一、单选题
-
1. 化学与生活密切相关,下列说法正确的是( )A、赏心悦目的雕花玻璃通常是用氢氟酸对玻璃进行刻蚀而制成的 B、硅单质常被用于制造太阳能电池和制作光导纤维 C、氢氧化钠溶液不能用玻璃试剂瓶来盛放 D、玻璃、水泥、水晶项链都是硅酸盐制品2. 雷雨天闪电时空气中有臭氧生成,下列说法正确的是( )A、O2和O3互为同位素 B、O2和O3的相互转化是物理变化 C、等物质的量的O2和O3含有相同的质子数 D、在相同的温度与压强下,等体积的O2和O3含有相同的分子数3. 用铁片与稀硫酸反应制氢气时,下列措施不能使反应速率加快的是( )A、加热 B、滴加少量CuSO4溶液 C、不用稀硫酸,改用98%的浓硫酸 D、再加入相同的一个铁片4. 粗盐水过滤后仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤可以除去这些杂质。
①加入稍过量的Na2CO3溶液; ②加入稍过量的NaOH溶液:
③加入稍过量的BaCl2溶液: ④过滤; ⑤滴入稀盐酸至无气泡产生。
正确的操作顺序是( )
A、①③②④⑤ B、③②①④⑤ C、②③①⑤④ D、③④②①⑤5. 对下列有关事实的解释,其中错误的是( )A、浓硝酸在光照条件下其颜色变黄,说明浓硝酸不稳定,见光容易分解 B、常温下,浓硝酸可以用铝槽贮存,说明铝与浓硝酸不能反应 C、向CuSO4•5H2O晶体中滴加少量浓硫酸,晶体表面出现“白斑”,说明浓硫酸具有吸水性 D、在蔗糖固体中加入适量浓硫酸后出现发黑现象,说明浓硫酸具有脱水性6. 下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )



A.反应物总能量大于生成物总能量
B.反应开始后,针筒活塞向右移动
C.反应开始后,甲处液面低于乙处液面
D.温度计的水银柱不断上升
A、A B、B C、C D、D7. 假设某化学反应的反应过程如图所示,观察分析,符合图中变化的化学反应为( ) A、 B、 C、 D、8. 利用下列实验装置能达到实验目的的是( )
A、 B、 C、 D、8. 利用下列实验装置能达到实验目的的是( )



A.检验氨气极易溶于水
B.制取并干燥氨气
C.制取并收集二氧化氮
D.将化学能转化为电能
A、A B、B C、C D、D9. 研究表明,氮氧化物(NOx)和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如图所示:
下列关于雾霾及其形成的叙述中,错误的是( )
A、与燃料燃烧有关 B、涉及氧化还原反应、化合反应等 C、雾霾中含有NH4NO3 和(NH4)2SO4 D、NH3是形成无机颗粒物的催化剂10. 下列反应的离子方程式书写正确的是( )A、铜片与浓硝酸发生反应: B、NaOH溶液与NH4Cl溶液混合加热: C、氨水中加入氯化铁溶液: D、向Fe(NO3)2稀溶液中加入盐酸发生反应:11. 将过量CO2通入下列溶液中,始终不会出现浑浊的是( )A、Ca(OH)2溶液 B、饱和Na2CO3溶液 C、CaCl2溶液 D、水玻璃12. 如图所示是425℃时,在1L密团容器中发生化学反应的浓度随时间的变化示意图。下列叙述错误的是( ) A、图①中t0时,反应达到平衡状态 B、图①中t0时,三种物质的物质的量相同 C、当反应都达平衡时,图①②中 D、图①②中当 时,反应达到平衡状态13. 已知一定质量的锌粒与稀盐酸反应,生成H2的浓度与反应时间的关系如图所示,下列结论错误的是( )
A、图①中t0时,反应达到平衡状态 B、图①中t0时,三种物质的物质的量相同 C、当反应都达平衡时,图①②中 D、图①②中当 时,反应达到平衡状态13. 已知一定质量的锌粒与稀盐酸反应,生成H2的浓度与反应时间的关系如图所示,下列结论错误的是( ) A、反应速率υ(0-2min)﹥υ(2-4min)﹥υ(4-6min) B、反应前4min内温度对反应速率的影响比浓度大 C、若将锌粒改为锌粉,可加快产生H2的反应速率 D、反应前4min内生成H2的平均速率υ(H2)=0.09mol·L-1·min-114. 已知CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),在1L密闭容器中分别加入0.5mol CH4和1 mol NO2保持温度不变,测得n(CH4 )随时间变化的有关实验数据如表所示。下列说法错误的是( )
A、反应速率υ(0-2min)﹥υ(2-4min)﹥υ(4-6min) B、反应前4min内温度对反应速率的影响比浓度大 C、若将锌粒改为锌粉,可加快产生H2的反应速率 D、反应前4min内生成H2的平均速率υ(H2)=0.09mol·L-1·min-114. 已知CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),在1L密闭容器中分别加入0.5mol CH4和1 mol NO2保持温度不变,测得n(CH4 )随时间变化的有关实验数据如表所示。下列说法错误的是( )时间/min
0
10
20
30
40
50
n(CH4)/mol
0.5
0.35
0.25
0.17
0.10
0.10
A、0~20min内,NO2 的反应速率为0.025 mol•L-1•min-1 B、由实验数据可知,该反应在50min时才达平衡状态 C、随着反应的进行,反应物的浓度降低,反应速率减慢 D、达平衡时,二氧化氮的转化率与甲烷的转化率相等15. 肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H所需的能量(kJ)是( ) A、194 B、391 C、516 D、65816. 下列图像分别表示有关反应的反应过程与能量变化的关系
A、194 B、391 C、516 D、65816. 下列图像分别表示有关反应的反应过程与能量变化的关系
据此判断下列说法中正确的是( )
A、石墨转变为金刚石是吸热反应 B、白磷比红磷稳定 C、①S(g)+O2(g)=SO2(g);②S(s)+O2(g)=SO2(g);放出热量:①˂② D、CO(g)+H2O(g)=CO2(g)+ H2 (g);该反应为吸热反应17. 下图所示是一种综合处理SO2废气的工艺流程,假设每步都完全反应。下列说法正确的是( )A、溶液B中发生的反应为 B、此工艺的优点之一是物质能循环利用 C、由以上流程可推知氧化性: D、可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+18. 研究硫酸铜的量对锌与稀硫酸反应氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。实验
混合溶液
A
B
C
D
E
F
4mol/L H2SO4/mL
30
V1
V2
V3
V4
V5
饱和CuSO4溶液/mL
0
0.5
2.5
5
V6
20
H2O/mL
V7
V8
V9
V10
10
0
下列说法正确的是( )
A.反应一段时间后,实验
A、E中的金属呈暗红色 B、V1=30,V6=10 C、加入MgSO4与Ag2SO4可以起与硫酸铜相同的加速作用 D、硫酸铜的量越多,产生氢气的速率肯定越快二、综合题
-
19. 氨在人类的生产和生活中有着广泛的应用。某化学兴趣小组利用下图装置探究氨气的有关性质。
 (1)、装置A中烧瓶内试剂可选用(填序号),B的作用是。
(1)、装置A中烧瓶内试剂可选用(填序号),B的作用是。a.碱石灰 b.生石灰 c.浓硫酸 d.烧碱溶液
(2)、连接好装置并检验装置的气密性后,装入试剂,然后应先(填Ⅰ或Ⅱ)。Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水
Ⅱ.加热装置C
(3)、实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为;该反应证明氨气具有性。 (4)、该实验缺少尾气吸收装置,上图中能用来吸收尾气的装置是(填装置序号)。(5)、氨气极易溶于水,若标准状况下,将2.24 L的氨气溶于水配成1 L溶液,所得溶液的物质的量浓度为 mol·L-1。20. 某同学为了检验浓硫酸与木炭粉在加热条件下反应(C+2H2SO4(浓)
(4)、该实验缺少尾气吸收装置,上图中能用来吸收尾气的装置是(填装置序号)。(5)、氨气极易溶于水,若标准状况下,将2.24 L的氨气溶于水配成1 L溶液,所得溶液的物质的量浓度为 mol·L-1。20. 某同学为了检验浓硫酸与木炭粉在加热条件下反应(C+2H2SO4(浓) CO2↑+2SO2↑+2H2O)产生的所有气体产物,选用了如下图所示的实验装置。
CO2↑+2SO2↑+2H2O)产生的所有气体产物,选用了如下图所示的实验装置。  (1)、①中无水硫酸铜的作用是。(2)、②中酸性KMnO4溶液的作用是。(3)、②中两次用到品红溶液,它们的作用分别是A , B。(4)、③中出现的现象是 ,
(1)、①中无水硫酸铜的作用是。(2)、②中酸性KMnO4溶液的作用是。(3)、②中两次用到品红溶液,它们的作用分别是A , B。(4)、③中出现的现象是 ,发生反应的离子方程式是。
三、综合题
-
21. 原电池是将化学能转化为电能的装置。
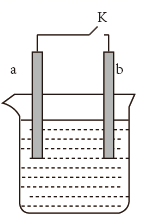 (1)、a为铜片,b为铁片,烧杯中是稀硫酸溶液。
(1)、a为铜片,b为铁片,烧杯中是稀硫酸溶液。①当开关K断开时产生的现象为。
A.a不断溶解
B.b不断溶解
C.a上产生气泡
D.b上产生气泡
E.溶液逐渐变蓝
②闭合开关K,反应一段时间后断开开关K,经过一段时间后,下列叙述错误的是。
A.溶液中H+浓度减小 B.正极附近 浓度逐渐增大
C.溶液中含有FeSO4 D.溶液中 浓度基本不变
(2)、FeCl3常用于腐蚀印刷电路铜板,若将此反应设计成原电池,请写出该原电池正极电极反应为。(3)、下图为氢氧燃料电池的结构示意图,电解质溶液为NaOH溶液,电极材料为疏松多孔的石墨棒。请回答下列问题: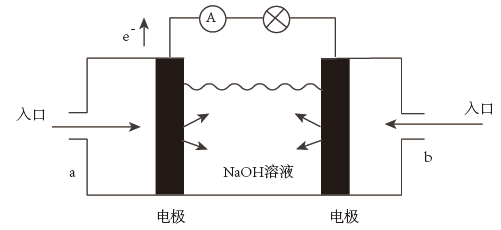
①a极通入的物质为 , 电解质溶液中的 移向极(选填“负”或“正”)。
②写出此氢氧燃料电池工作时,负极的电极反应式:。
③当消耗氢气11.2L(标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为mol。
22. 汽车尾气中含有CO、NO等有害气体。(1)、汽车尾气中NO生成过程的能量变化如图所示。1molN2和1molO2完全反应生成NO会(选填“吸收”或“放出”)kJ能量。 (2)、一种新型催化剂用于NO和CO的反应: 。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
(2)、一种新型催化剂用于NO和CO的反应: 。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。实验编号
t(℃)
NO初始浓度(mol/L)
CO初始浓度(mdl/L)
催化制的比表面积(m2/g)
I
280
82
II
280
b
124
III
350
a
82
①请将表中数据补充完整:a为。
②能验证温度对化学反应速率影响规律的是实验(填实验序号)。
③实验I和实验II中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验II的是曲线(选填“甲”或“乙”)。
