山东省日照市五莲县2020-2021学年高一下学期化学期中考试试卷
试卷更新日期:2021-06-01 类型:期中考试
一、单选题
-
1. 化学与生产、生活密切相关。下列说法正确的是( )
 A、如图,对钢管的防护措施为牺牲阳极保护法 B、硅太阳能电池将化学能转化为电能 C、燃料电池的能量转化率为 D、太阳能、氢能、核能、生物质能、水能都属于新能源2. 下列叙述正确的是( )A、由于 键比 键牢固,所以水的熔沸点比 高 B、离子化合物中一定有离子键,可能有共价键,非金属单质中一定含有共价键 C、硝酸水溶液中含有 和 ,故 为离子化合物 D、某化合物熔融状态下能导电,该化合物一定为离子化合物3. 下列有关电解的叙述正确的是( )A、工业上用电解熔融 的方法制取 时,阳极材料可以是石墨或铁 B、可以用电解熔融的 来制取 C、工业上电解饱和食盐水制备烧碱,采用阳离子交换膜 D、电解精炼铜时,溶液中铜离子的浓度不变4. 下列叙述正确的是( )A、已知 则 的燃烧热为 B、已知 , ,则 C、含 的稀溶液与稀盐酸完全中和,放出 的热量,则 D、已知C(石墨,s)=C(金刚石,s) ,则金刚石比石墨稳定5. 下列关于有效碰撞理论以及活化分子的说法中错误的是( )A、对有气体参加的化学反应,增大压强,体系体积减小,活化分子总数不变,但单位体积内活化分子数增加,从而反应速率增大 B、活化分子之间发生的碰撞不一定为有效碰撞 C、升高温度,可使活化分子的百分数增大,从而反应速率增大 D、加入适宜的催化剂,使分子能量增加,活化分子的百分数大大增加,从而成千上,万倍地增大反应速率6. 下列物质中只含离子键的是( )A、 B、 C、 D、7. 对可逆反应 ,下列叙述正确的是( )A、若保持温度和体积不变,充入少量N2使压强增大,反应速率加快 B、单位时间内生成x molNO,同时消耗x molNH3到化学平衡状态 C、达到化学平衡状态时,若升高温度,则正反应速率减小,逆反应速率增大 D、任意时刻,化学反应速率关系:3v正(NH3)=2v正(H2O)8. 已知:2SO2(g)+O2(g) 2SO3(g) ΔH=xkJ·mol–1 , 不同条件下反应过程能量变化如图所示。下列说法中错误的是( )
A、如图,对钢管的防护措施为牺牲阳极保护法 B、硅太阳能电池将化学能转化为电能 C、燃料电池的能量转化率为 D、太阳能、氢能、核能、生物质能、水能都属于新能源2. 下列叙述正确的是( )A、由于 键比 键牢固,所以水的熔沸点比 高 B、离子化合物中一定有离子键,可能有共价键,非金属单质中一定含有共价键 C、硝酸水溶液中含有 和 ,故 为离子化合物 D、某化合物熔融状态下能导电,该化合物一定为离子化合物3. 下列有关电解的叙述正确的是( )A、工业上用电解熔融 的方法制取 时,阳极材料可以是石墨或铁 B、可以用电解熔融的 来制取 C、工业上电解饱和食盐水制备烧碱,采用阳离子交换膜 D、电解精炼铜时,溶液中铜离子的浓度不变4. 下列叙述正确的是( )A、已知 则 的燃烧热为 B、已知 , ,则 C、含 的稀溶液与稀盐酸完全中和,放出 的热量,则 D、已知C(石墨,s)=C(金刚石,s) ,则金刚石比石墨稳定5. 下列关于有效碰撞理论以及活化分子的说法中错误的是( )A、对有气体参加的化学反应,增大压强,体系体积减小,活化分子总数不变,但单位体积内活化分子数增加,从而反应速率增大 B、活化分子之间发生的碰撞不一定为有效碰撞 C、升高温度,可使活化分子的百分数增大,从而反应速率增大 D、加入适宜的催化剂,使分子能量增加,活化分子的百分数大大增加,从而成千上,万倍地增大反应速率6. 下列物质中只含离子键的是( )A、 B、 C、 D、7. 对可逆反应 ,下列叙述正确的是( )A、若保持温度和体积不变,充入少量N2使压强增大,反应速率加快 B、单位时间内生成x molNO,同时消耗x molNH3到化学平衡状态 C、达到化学平衡状态时,若升高温度,则正反应速率减小,逆反应速率增大 D、任意时刻,化学反应速率关系:3v正(NH3)=2v正(H2O)8. 已知:2SO2(g)+O2(g) 2SO3(g) ΔH=xkJ·mol–1 , 不同条件下反应过程能量变化如图所示。下列说法中错误的是( ) A、反应的ΔH<0 B、过程b使用了催化剂 C、使用催化剂可以提高SO2的平衡转化率 D、过程b发生两步反应,第一步为吸热反应9. 下列装置不能符合题意完成相关实验是( )
A、反应的ΔH<0 B、过程b使用了催化剂 C、使用催化剂可以提高SO2的平衡转化率 D、过程b发生两步反应,第一步为吸热反应9. 下列装置不能符合题意完成相关实验是( )A
B
C
D
装置




实验
测定中和热
验证铁的活泼性强于铜
结合秒表测量 和硫酸反应的速率
验证铁的吸氧腐蚀
A.
A、 B、B C、C D、D10. 下面是几种常见的化学电源示意图,有关说法错误的是( ) A、上述电池分别属于一次电池、二次电池和燃料电池 B、如图所示,干电池使用时电子从锌筒流向石墨电极,再通过电解质到锌筒 C、铅蓄电池工作过程中,每通过 电子,负极质量增重 D、碱性氢氧燃料电池正极的电极反应式为:11. 高炉炼铁中发生的基本反应之一为: ,已知 时 。下列说法错误的是( )A、该反应的平衡常数表达式为 B、平衡后再加入 ,反应速率会变大 C、若改变条件,使平衡发生移动,平衡常数不一定改变 D、 时测得高炉中 ,此时v正大于v逆12. 研究人员研制出一种可快速充放电的超性能铝离子电池, 为电极,有机阳离子与阴离子( 、 )组成的离子液体为电解质,该电池放电过程示意图如下。下列说法正确的是( )
A、上述电池分别属于一次电池、二次电池和燃料电池 B、如图所示,干电池使用时电子从锌筒流向石墨电极,再通过电解质到锌筒 C、铅蓄电池工作过程中,每通过 电子,负极质量增重 D、碱性氢氧燃料电池正极的电极反应式为:11. 高炉炼铁中发生的基本反应之一为: ,已知 时 。下列说法错误的是( )A、该反应的平衡常数表达式为 B、平衡后再加入 ,反应速率会变大 C、若改变条件,使平衡发生移动,平衡常数不一定改变 D、 时测得高炉中 ,此时v正大于v逆12. 研究人员研制出一种可快速充放电的超性能铝离子电池, 为电极,有机阳离子与阴离子( 、 )组成的离子液体为电解质,该电池放电过程示意图如下。下列说法正确的是( ) A、充电时, 电极接外接电源正极 B、充电时,每生成 铝,同时消耗 C、放电时,电解质中的有机阳离子向铝电极方向移动 D、放电时,正极反应式为
A、充电时, 电极接外接电源正极 B、充电时,每生成 铝,同时消耗 C、放电时,电解质中的有机阳离子向铝电极方向移动 D、放电时,正极反应式为二、多选题
-
13. 下列关于反应速率与参与反应物质的浓度关系式 的叙述中错误的是( )A、对于所有化学反应,k是数值不变的常数 B、a、b是化学方程式中A、B物质的系数 C、对于某个给定的化学反应,k与反应物的浓度无关 D、反应速率与参与反应物质的浓度关系式是通过实验测定的结果,不能随意根据方程式直接写出14. 利用电解法可将含有 等杂质的粗铜提纯。下列叙述中正确的是( )A、电解时精铜作阳极 B、粗铜连接电源的负极 C、电解时阴极上发生的电极反应为 D、电解后,电解槽底部会形成含有少量 等金属的阳极泥15. 一定条件下,将 气体和 气体混合于固定容积为 的密闭容器中,发生反应: 。 末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
 A、若混合气体的密度不再改变时,该反应不一定达到平衡状态 B、平衡时C的体积分数为 C、反应过程中A和B的转化率之比为3:1 D、从开始到平衡,用A表示的化学反应速率为
A、若混合气体的密度不再改变时,该反应不一定达到平衡状态 B、平衡时C的体积分数为 C、反应过程中A和B的转化率之比为3:1 D、从开始到平衡,用A表示的化学反应速率为三、综合题
-
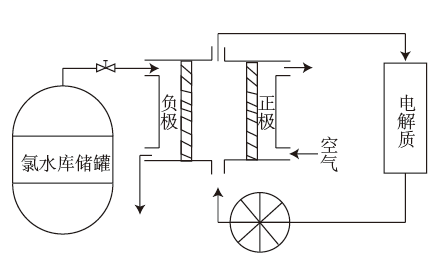
16. A、B、D、E、F、G为短周期元素,且原子序数依次增大。A、F同主族,E、G同主族。A与其他非金属元素化合时易形成共价键,F与其他非金属元素化合时易形成离子键,且 与 核外电子排布相同。由以上元素组成的物质 和 具有相同的电子数。回答下列问题:(1)、G在周期表中的位置为。(2)、由A、D、E三种元素形成的离子化合物的化学式是。(3)、 的电子式为 , 含有化学键(填“离子键”或“共价键”)。(4)、由A、F两种元素形成的一种离子化合物X,常温下与水迅速反应生成气体,该反应的化学方程式为。(5)、D的最简单气态氢化物可用于燃料电池,电池工作时生成无毒物质,工作原理如图所示。该燃料电池的电解质溶液最好选择碱性溶液,则负极电极反应式为。
 17. 能源是现代文明的原动力,通过化学方法可以使能源按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。回答下列问题:(1)、氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下, , 。则常温下水的分解不能自发进行的热力学依据是。(2)、已知反应:
17. 能源是现代文明的原动力,通过化学方法可以使能源按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。回答下列问题:(1)、氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下, , 。则常温下水的分解不能自发进行的热力学依据是。(2)、已知反应:①在某温度下该反应的平衡常数为K,则其逆反应的平衡常数为(用含K的式子表示)。
②下图是该反应中能量变化示意图。

则 和 反应生成 和 的活化能为 , 和 反应的热化学方程式为。
(3)、燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:①
②
③
则 。
(4)、已知一些化学键的键能数据如表所示:化学键
键能/
414
489
565
155
请根据键能数据写出 和 反应生成 和 的热化学方程式:。
18. 在 密闭容器中, 时,反应 体系中 随时间的变化如下表所示。时间/s
0
1
2
3
4
5
0.020
0.010
0.008
0.007
0.007
0.007
 (1)、上图中,A点处v正v逆 (填“大于”“小于”或“等于”)。(2)、图中表示 变化的曲线是。平衡时 的转化率为。(3)、下列能说明该反应已经达到平衡状态的是(填字母,下同)。
(1)、上图中,A点处v正v逆 (填“大于”“小于”或“等于”)。(2)、图中表示 变化的曲线是。平衡时 的转化率为。(3)、下列能说明该反应已经达到平衡状态的是(填字母,下同)。a. b.
c.容器内的密度保持不变 d.容器内压强保持不变
(4)、下列措施不能使该反应的反应速率增大的是。a.及时分离出 气体 b.适当升高温度
c.增大 的浓度 d.选择高效的催化剂
(5)、此反应在三种不同情况下的反应速率分别为:① ② ③ 其中反应速率最快的是(填序号)。19. 采用如图所示装置模拟工业生产。已知:钾离子交换摸只让钾离子通过分子及其它离子均不能通过。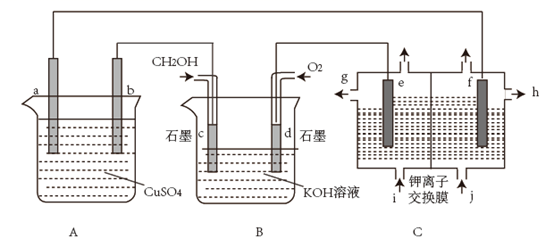
回答下列问题:
(1)、若在A池中实现铁上镀铜,b电极的电极材料为。(2)、若A池中a、b电极材料均为惰性电极,电解一段时间后,两极均有气体产生,则向溶液中加入(填化学式固体可以使溶液恢复到电解前的情况。(3)、B池中,c电极为极(填“正”或“负”),电极反应式为。(4)、若在C池中用 溶液制取 溶液和氯气,高浓度的 溶液从口出(填图中字母),当d电极消耗标准状况下 时,C池中阳极室溶液质量减少g。20. 碘在科研与生活中有重要应用。某兴趣小组用 、 淀粉溶液、 、 等试剂,探究反应条件对化学反应速率的影响。已知: 。回答下列问题:(1)、向 与淀粉的混合溶液中加入一定量的 溶液,当溶液中的耗尽后,溶液颜色将由无色变成为蓝色。为确保能观察到蓝色, 与 初始的物质的量需满足的关系为: 2(填“>”“<”“=”)。(2)、为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:实验序号
体积/
溶液
水
溶液
溶液
淀粉溶液
①
10.0
0.0
4.0
4.0
2.0
②
9.0
1.0
4.0
4.0
2.0
③
8.0
Vx
4.0
4.0
2.0
表中Vx = 。若实验①中观察到溶液变蓝的时间为 ,则用 的浓度变化表示的反应速率为。
(3)、已知某条件下,浓度 ~反应时间t的变化曲线如图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时 的变化曲线示意图(进行相应的标注) 。