山东省济宁市任城区2020-2021学年高一下学期化学期中考试试卷
试卷更新日期:2021-06-01 类型:期中考试
一、单选题
-
1. 人类生活离不开化学,下列有关叙述正确的是( )A、生物质能源是人类最早利用的能源 B、玻璃是人类最早使用的硅酸盐产品 C、金属铝是现今社会中使用量最多的金属 D、水力发电、风力发电、太阳能发电、核电是现今电能的最主要来源2. 实验室中下列做法正确的是( )A、用带橡胶塞的棕色试剂瓶保存浓硝酸 B、用浓硫酸干燥硫化氢 C、用酒精灯直接加热蒸发皿 D、用N2作冷却液态镁的保护气3. 下列叙述不涉及氧化还原反应的是( )A、氮的固定 B、氢氟酸雕刻玻璃 C、粗硅的提纯 D、大气中NO2参与酸雨形成4. 下列有关有机物的说法正确的是( )A、甲烷的空间充填模型为:
 B、氟利昂(
B、氟利昂(  )是甲烷的氯、氟代物,它共有两种同分异构体
C、戊烷分子中的极性键与非极性键个数比为3∶1
D、CH3OH、
)是甲烷的氯、氟代物,它共有两种同分异构体
C、戊烷分子中的极性键与非极性键个数比为3∶1
D、CH3OH、  、
、  三种有机物互为同系物
5. 把a、b、c、d四块金属浸入稀硫酸中,用导线两两连接组成多个原电池,若a、b相连,a为负极;c、d相连,d上有气泡逸出;a、c相连,a极减轻;b、d相连,b为正极。则四种金属的活泼性顺序为 ( )A、a>b>c>d B、a>c>b>d C、a>c>d>b D、b>d>c>a6. 下列关于C、Si及其化合物结构与性质的论述正确的是( )A、C和Si的最高价氧化物都是酸性氧化物,且都能与水反应生成相应的最高价含氧酸 B、SiC与金刚石成键方式、结构特点均相似,因此具有很高的硬度 C、CH4、SiH4中H的化合价相同都是+1价 D、碳酸钠和硅酸钠都是正盐,它们的水溶液都呈中性7. 利用下列装置(夹持装置略)进行实验,不能达到实验目的的是( )
三种有机物互为同系物
5. 把a、b、c、d四块金属浸入稀硫酸中,用导线两两连接组成多个原电池,若a、b相连,a为负极;c、d相连,d上有气泡逸出;a、c相连,a极减轻;b、d相连,b为正极。则四种金属的活泼性顺序为 ( )A、a>b>c>d B、a>c>b>d C、a>c>d>b D、b>d>c>a6. 下列关于C、Si及其化合物结构与性质的论述正确的是( )A、C和Si的最高价氧化物都是酸性氧化物,且都能与水反应生成相应的最高价含氧酸 B、SiC与金刚石成键方式、结构特点均相似,因此具有很高的硬度 C、CH4、SiH4中H的化合价相同都是+1价 D、碳酸钠和硅酸钠都是正盐,它们的水溶液都呈中性7. 利用下列装置(夹持装置略)进行实验,不能达到实验目的的是( ) A、利用图甲快速制备少量氨气 B、利用图乙从废旧干电池糊状混合物中回收二氧化锰 C、利用图丙测定反应速率 D、利用图丁实现Cu+H2SO4=CuSO4+H2↑8. 推理是一种重要的能力。打开分液漏斗活塞,进行如图所示的探究实验,对实验现象的预测及分析错误的是( )
A、利用图甲快速制备少量氨气 B、利用图乙从废旧干电池糊状混合物中回收二氧化锰 C、利用图丙测定反应速率 D、利用图丁实现Cu+H2SO4=CuSO4+H2↑8. 推理是一种重要的能力。打开分液漏斗活塞,进行如图所示的探究实验,对实验现象的预测及分析错误的是( ) A、试管内CCl4层溶液褪色,说明Br2具有氧化性 B、试管中的红色花瓣褪色,说明SO2具有漂白性 C、试管中产生大量气泡,说明Na2SO3被氧化产生SO3 D、一段时间后试管内有白色沉淀,说明有SO 生成9. 试剂级NaCl可用海盐(含泥沙、海藻、K+、Ca2+、Mg2+、Fe3+、 等杂质)为原料制备。实验室模拟制备流程简图如下:
A、试管内CCl4层溶液褪色,说明Br2具有氧化性 B、试管中的红色花瓣褪色,说明SO2具有漂白性 C、试管中产生大量气泡,说明Na2SO3被氧化产生SO3 D、一段时间后试管内有白色沉淀,说明有SO 生成9. 试剂级NaCl可用海盐(含泥沙、海藻、K+、Ca2+、Mg2+、Fe3+、 等杂质)为原料制备。实验室模拟制备流程简图如下: 下列有关说法错误的是( )A、焙炒海盐可以除去海藻等有机杂质,并使其颗粒变小,加速溶解 B、除杂过程中只需按照氢氧化钠溶液、氯化钡溶液、碳酸钠溶液的顺序添加试剂即可 C、操作X为蒸发浓缩 D、制备过程中用到坩埚、蒸发皿、玻璃棒、坩埚钳等仪器10. 电池是人类生产和生活中的重要能量来源,各式各样的电池的发明是化学对人类的一项重大贡献。下列有关电池的叙述正确的是( )A、太阳能电池的主要材料是高纯度的二氧化硅 B、氢氧燃料电池可将热能直接转变为电能 C、铅蓄电池充电时也发生了氧化还原反应 D、氢氧燃料电池工作时,H2在负极上得到电子11. 下列各实验的现象及结论都正确的个数是( )
下列有关说法错误的是( )A、焙炒海盐可以除去海藻等有机杂质,并使其颗粒变小,加速溶解 B、除杂过程中只需按照氢氧化钠溶液、氯化钡溶液、碳酸钠溶液的顺序添加试剂即可 C、操作X为蒸发浓缩 D、制备过程中用到坩埚、蒸发皿、玻璃棒、坩埚钳等仪器10. 电池是人类生产和生活中的重要能量来源,各式各样的电池的发明是化学对人类的一项重大贡献。下列有关电池的叙述正确的是( )A、太阳能电池的主要材料是高纯度的二氧化硅 B、氢氧燃料电池可将热能直接转变为电能 C、铅蓄电池充电时也发生了氧化还原反应 D、氢氧燃料电池工作时,H2在负极上得到电子11. 下列各实验的现象及结论都正确的个数是( )序号
实 验 操 作
实 验 现 象
实 验 结 论
①
把SO2和气体X一起通入到BaCl2溶液中
有白色沉淀产生
X气体具有强氧化性
②
向溶液Y中加入浓氢氧化钠溶液并加热
有气体产生,该气体使湿润的红色石蕊试纸变蓝
溶液Y一定是铵盐溶液
③
过量铁粉加入稀硝酸中,充分反应后,滴加KSCN溶液
有无色气泡产生,溶液呈血红色
稀硝酸能将Fe氧化成Fe3+
④
向某溶液中加入稀硫酸
生成淡黄色沉淀和能使品红溶液褪色的刺激性气味的气体
该溶液中一定含有S2O
A、0 B、1 C、2 D、312. 在2L恒温密闭容器中通入等物质的量的N2和H2并发生反应:N2 +3H2 2NH3 (正反应放热),下列叙述正确的是( )A、升高温度正反应速率升高,逆反应速率降低 B、若5min后NH3的物质的量为0.6mol,则0到5min内的正反应平均速率 v(H2)=5.4mol/(L·S) C、一段时间后N2和H2的物质的量比为2:1,则N2的转化率为20% D、当N2的体积分数不再改变时,说明该可逆反应处于平衡状态二、多选题
-
13. 将一定量的有机物充分燃烧后的产物通入足量的石灰水中完全吸收,经过滤得沉淀20g,滤液质量比原石灰水减少5.8g,该有机物可能是( )A、甲烷 B、乙烷 C、丙烷 D、乙醇(CH3CH2OH)14. 如图所示的物质转化关系中,A是常见的气态氢化物,B是能使带火星的木条复燃的无色、无臭气体,E的相对分子质量比D的大17,G是一种紫红色金属单质(反应条件和部分生成物未列出)。

对图中有关物质及反应的叙述正确的是( )
A、液态的A汽化时吸收大量的热,因此可用作制冷剂 B、D与水反应能生成酸,因此D是酸性氧化物 C、因为E具有强氧化性,所以不能用铝制容器盛装 D、图中涉及反应均为氧化还原反应15. 如图是 1mol CO(g)和 2mol H2(g)发生反应 CO(g)+2H2(g)→CH3OH(g)过程中的能量变化曲线。曲线 a 表示不使用催化剂时反应的能量变化,曲线 b 表示使用催化剂时反应的能量变化。下列相关说法正确的是( ) A、使用催化剂后该反应从放热反应变成了吸热反应 B、使用和不使用催化剂相比反应的能量变化相同 C、1mol CO(g)和2mol H2(g)中的化学键完全被破坏需要释放 419kJ能量 D、1mol CO(g)和2mol H2(g)完全反应生成1mol CH3OH(g)会释放出91kJ能量
A、使用催化剂后该反应从放热反应变成了吸热反应 B、使用和不使用催化剂相比反应的能量变化相同 C、1mol CO(g)和2mol H2(g)中的化学键完全被破坏需要释放 419kJ能量 D、1mol CO(g)和2mol H2(g)完全反应生成1mol CH3OH(g)会释放出91kJ能量三、填空题
-
16. 化学反应中伴随着能量变化,探究各种能量变化是一永恒的主题。(1)、下列变化属于放热反应的是(填序号)。
a.生石灰溶于水 b.浓硫酸稀释 c.碳酸氢钠固体溶于盐酸
d.铜溶于浓硝酸 e.氯化铵固体与氢氧化钡晶体混合搅拌 f.过氧化钠溶于水
(2)、H2O2分解时的能量变化关系如图所示,则H2O2分解反应为反应(选填:吸热、放热)。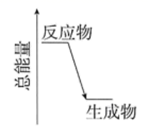
查阅资料得知:将作为催化剂的Fe2(SO4)3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是:2Fe3++H2O2=2Fe2++O2↑+2H+和。
(3)、如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置:
①当电极a为镁,电极b为铝,电解质溶液为氢氧化钠溶液时,该电池的负极为(填名称)。
②燃料电池的工作原理是将燃料和氧化剂(O2)反应所产生的化学能直接转化为电能。现设计一燃料电池,电极a通入氢气燃料,采用氢氧化钠溶液为电解液,b极的电极反应式为。
③质量相同的铜棒和铁棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12 g,则导线中通过的电子的数目为。
17. 已知某链状烷烃分子中电子数为42。(1)、该烷烃的分子式为。(2)、该烷烃共有种同分异构体,其中:①甲在相同条件下沸点最高,甲的结构简式是。
②乙的一氯代物共有4种,乙的名称是。
③丙的所有H化学性质完全相同,写出丙与Cl2按照1:1的比例发生反应的化学方程式: 。
④键线式是以线表示共价键,每个折点或端点表示一个碳原子,并省略书写氢原子的一种表示有机化合物结构的式子,如异丁烷(
 )可表示为“
)可表示为“  ”,请分析这一表示方式的要领,写出乙的键线式:。(3)、该烷烃的同系物中不存在同分异构体的共有种。18. 某学生为了探究锌与硫酸反应过程中速率的变化,在100 mL0.2 mol/L的硫酸中加入1.3 g的锌粒,用排水集气法收集反应放出的氢气,实验记录如下:
”,请分析这一表示方式的要领,写出乙的键线式:。(3)、该烷烃的同系物中不存在同分异构体的共有种。18. 某学生为了探究锌与硫酸反应过程中速率的变化,在100 mL0.2 mol/L的硫酸中加入1.3 g的锌粒,用排水集气法收集反应放出的氢气,实验记录如下:时间/min
1
2
3
4
5
氢气体积/mL
50
112
232
280
310
(1)、该同学通过上表数据分析,认为影响该反应速率的外界因素有。(2)、“2~4”时间段平均反应速率为v(H2)=mL/min。(3)、如果要加快反应速率而又不减少产生氢气的量,下列措施你认为可行的是(填序号)。a.加热 b.加入1 mol/L的硫酸 c.加入少量CuSO4固体 d.把锌粒磨成锌粉
(4)、为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。实验混合溶液
A
B
C
4 mol·L-1H2SO4/mL
30
V1
V2
饱和CuSO4溶液/mL
0
0.5
2.5
H2O/mL
10
V3
V4
t/s
t1
t2
t3
①请完成该实验设计:V1= , V4=。
②实验结果t3>t1>t2 , 试解释t1>t2的原因: , t3>t1的原因:。
19. 某小组同学在实验室设计实验模拟工业生产。(1)、Ⅰ.用消石灰和氯化铵固体制备NH3
NH3的发生装置应选择图中的(填字母代号),制备NH3的化学方程式为。
(2)、欲收集一瓶干燥的NH3 , 选择图中的装置,其连接顺序为:发生装置→(按气流方向,用小写字母表示)。(3)、Ⅱ.设计了如图所示的实验装置模拟工业生产制备少量硝酸。
实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是(填“吸热”或“放热”)反应,反应的化学方程式是。
(4)、B中试剂为 , NaOH溶液的作用是。(5)、控制氨气和氧气的比例是制备硝酸的关键。①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。白烟的化学式是。
②欲使氨气尽可能完全转化为硝酸,理论上n(NH3):n(O2)的最佳比例为。
20. 利用硫铁矿(主要成分FeS2)生产硫酸和绿矾(FeSO4·7H2O)的工业流程示意图如下: (1)、沸腾炉中,硫铁矿进行粉碎处理的目的是。(2)、反应釜中,烧渣经过反应转化为溶液I和固体。
(1)、沸腾炉中,硫铁矿进行粉碎处理的目的是。(2)、反应釜中,烧渣经过反应转化为溶液I和固体。①烧渣中的FeS在反应中作剂(填“氧化”或“还原”)。
②溶液I中所含溶质的化学式是。
(3)、操作a的主要步骤是:加热浓缩、、过滤洗涤。(4)、流程中,固体X可以选择硫铁矿(FeS2)或。(5)、接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是。若在一体积固定的容器中加入2 mol SO2与1 mol O2模拟该反应,下列各项可作为该反应达到平衡状态的标志的是(填序号)。A.混合气体的质量不再变化 B.SO2与O2的物质的量比例不变
C.气体密度不再变化 D.气体的平均相对分子质量不再变化
E.SO2的消耗速率与O2的生成速率之比为1:2
若将模拟反应容器中的气体通入到酸性高锰酸钾溶液中,可以恰好使200 mL3 mol/L的高锰酸钾溶液褪色,则模拟反应器中SO2的转化率为。