广东省信宜市2020-2021学年高一下学期化学期中考试试卷
试卷更新日期:2021-06-01 类型:期中考试
一、单选题
-
1. 下列设备工作时,将化学能转化为热能的是( )A、
 硅太阳能电池
B、
硅太阳能电池
B、 锂离子电池
C、
锂离子电池
C、 太阳能集热器
D、
太阳能集热器
D、 燃气灶
2. 化学与环境密切相关,下列有关说法正确的是( )A、CO2属于大气污染物 B、大气中CO2含量的增加会导致温室效应加剧 C、CO2、NO2或SO2都会导致酸雨的形成 D、酸雨是pH小于7的雨水3. 下列相关的化学用语正确的是( )A、CH4分子空间填充模型:
燃气灶
2. 化学与环境密切相关,下列有关说法正确的是( )A、CO2属于大气污染物 B、大气中CO2含量的增加会导致温室效应加剧 C、CO2、NO2或SO2都会导致酸雨的形成 D、酸雨是pH小于7的雨水3. 下列相关的化学用语正确的是( )A、CH4分子空间填充模型: B、氮气的电子式:
B、氮气的电子式:  C、含10个中子的氧原子的核素符号: O
D、乙烷的分子式
4. 下列判断正确的是( )A、CH4和CH3CH2CH3互为同系物 B、H2、D2、T2互为同素异形体 C、 和 互为同分异构体 D、 和 互为同位素5. 化学与生产、生活、科技息息相关,下列叙述错误的是( )A、华为首款5G手机搭载了智能7nm制程SoC“麒麟980”手机芯片主要成分是二氧化硅 B、国产飞机C919用到氮化硅陶瓷是新型无机非金属材料 C、减少燃煤的使用可减少二氧化硫的排放,减少酸雨的危害 D、铵盐具有受热易分解的性质,在储存铵态氮肥时,应密封包装并放在阴凉通风处6. 在A(g)+2B(g)⇌3C(g)+4D(g)反应中,表示该反应速率最快的是( )A、v(A)=0.3 mol/(L·s) B、v(B)=0.5 mol/(L·s) C、v(C)=0.8 mol/(L·s) D、v(D)=2.0 mol/(L·s)7. 实验室制取、收集NH3 , 并组装NH3的喷泉实验装置。下列图示装置和原理能达到实验目的的是( )A、制NH3
C、含10个中子的氧原子的核素符号: O
D、乙烷的分子式
4. 下列判断正确的是( )A、CH4和CH3CH2CH3互为同系物 B、H2、D2、T2互为同素异形体 C、 和 互为同分异构体 D、 和 互为同位素5. 化学与生产、生活、科技息息相关,下列叙述错误的是( )A、华为首款5G手机搭载了智能7nm制程SoC“麒麟980”手机芯片主要成分是二氧化硅 B、国产飞机C919用到氮化硅陶瓷是新型无机非金属材料 C、减少燃煤的使用可减少二氧化硫的排放,减少酸雨的危害 D、铵盐具有受热易分解的性质,在储存铵态氮肥时,应密封包装并放在阴凉通风处6. 在A(g)+2B(g)⇌3C(g)+4D(g)反应中,表示该反应速率最快的是( )A、v(A)=0.3 mol/(L·s) B、v(B)=0.5 mol/(L·s) C、v(C)=0.8 mol/(L·s) D、v(D)=2.0 mol/(L·s)7. 实验室制取、收集NH3 , 并组装NH3的喷泉实验装置。下列图示装置和原理能达到实验目的的是( )A、制NH3 B、干燥NH3
B、干燥NH3 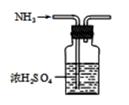 C、收集NH3
C、收集NH3  D、喷泉实验装置
D、喷泉实验装置  8. 下列食品添加剂中,其使用目的与反应速率有关的是( )A、抗氧化剂 B、调味剂 C、着色剂 D、增稠剂9. NA代表阿伏加德罗常数的数值。下列有关NA的叙述中,正确的是( )A、标准状况下,11.2 LCCl4所含的分子数为0.5NA B、14 g氮气所含的氮原子数为NA C、1 mol/L H2SO4 的阴、阳离子总数为3NA D、12 mol/L的浓硫酸 50 mL与足量的Cu加热反应,得到SO2为0.3NA10. 对于密闭容器中的可逆反应:N2(g)+3H2(g) 2NH3(g),400℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.下列叙述正确的是( )
8. 下列食品添加剂中,其使用目的与反应速率有关的是( )A、抗氧化剂 B、调味剂 C、着色剂 D、增稠剂9. NA代表阿伏加德罗常数的数值。下列有关NA的叙述中,正确的是( )A、标准状况下,11.2 LCCl4所含的分子数为0.5NA B、14 g氮气所含的氮原子数为NA C、1 mol/L H2SO4 的阴、阳离子总数为3NA D、12 mol/L的浓硫酸 50 mL与足量的Cu加热反应,得到SO2为0.3NA10. 对于密闭容器中的可逆反应:N2(g)+3H2(g) 2NH3(g),400℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.下列叙述正确的是( ) A、a点的正反应速率比b点的大 B、c点处反应达到平衡 C、d点和e点处n(N2)不相等 D、d点3v正(H2)= v逆(N2)11. 下列陈述Ⅰ、Ⅱ正确并且有因果关系的是 ( )
A、a点的正反应速率比b点的大 B、c点处反应达到平衡 C、d点和e点处n(N2)不相等 D、d点3v正(H2)= v逆(N2)11. 下列陈述Ⅰ、Ⅱ正确并且有因果关系的是 ( )选项
陈述Ⅰ
陈述Ⅱ
A
SO2有漂白性
SO2可使溴水褪色
B
SiO2有导电性
SiO2可用于制备光导纤维
C
BaSO4难溶于酸
用盐酸和BaCl2溶液检验
D
NH3能使酚酞溶液变红
NH3可用于设计喷泉实验
A、A B、B C、C D、D12. 在一密闭容器中加入A、B、C三种气体,保持一定温度,在 s测得各物质的浓度如表所示。下列结论正确的是( )测定时刻/s
6
3
2
2
5
3.5
3
3
1
2.5
3
3
A、 s时反应已经停止 B、 s内正、逆反应速率不相等 C、在容器中发生的反应为 D、 s内A的平均反应速率为13. 某反应由两步反应A→B→C构成,其反应能量曲线如图所示,下列叙述正确的是( ) A、两步反应均为吸热反应 B、三种物质中B最稳定 C、A与C的能量差为 D、A→B的反应不一定需要加热14. 一定条件下,物质的量均为 0.3mol 的 X(g)与Y(g)在容积固定的密闭容器中发生反应:X(g)+3Y(g)⇌2Z(g) ΔH=-akJ•mol -1 , 下列说法正确的是( )A、达到平衡后,向平衡体系中充入稀有气体,正反应速率不发生变化 B、反应一段时间后,X 与Y 的物质的量之比仍为 1:1 C、达到平衡时,反应放出 0.1akJ 的热量 D、X 与Y的物质的量相等,说明反应已达到平衡15. 下列关于自然界中氮循环(如图)的说法错误的是:( )
A、两步反应均为吸热反应 B、三种物质中B最稳定 C、A与C的能量差为 D、A→B的反应不一定需要加热14. 一定条件下,物质的量均为 0.3mol 的 X(g)与Y(g)在容积固定的密闭容器中发生反应:X(g)+3Y(g)⇌2Z(g) ΔH=-akJ•mol -1 , 下列说法正确的是( )A、达到平衡后,向平衡体系中充入稀有气体,正反应速率不发生变化 B、反应一段时间后,X 与Y 的物质的量之比仍为 1:1 C、达到平衡时,反应放出 0.1akJ 的热量 D、X 与Y的物质的量相等,说明反应已达到平衡15. 下列关于自然界中氮循环(如图)的说法错误的是:( ) A、含氮无机物和含氮有机物可相互转化 B、碳、氢、氧三种元素也参与了氮循环 C、工业合成氨属于人工固氮 D、氮元素均被氧化16. 陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是( )A、“雨过天晴云破处”所描述的瓷器青色,来自氧化铁 B、陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点 C、陶瓷是应用较早的人造材料,主要化学成分是硅酸盐 D、闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成
A、含氮无机物和含氮有机物可相互转化 B、碳、氢、氧三种元素也参与了氮循环 C、工业合成氨属于人工固氮 D、氮元素均被氧化16. 陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是( )A、“雨过天晴云破处”所描述的瓷器青色,来自氧化铁 B、陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点 C、陶瓷是应用较早的人造材料,主要化学成分是硅酸盐 D、闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成二、综合题
-
17. 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物,冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2。(1)、若CuFeS2中Fe的化合价为+2价,则反应中的氧化产物是(填化学式)。(2)、上述冶炼过程中会产生大量SO2 , 下列处理方案中合理的是_______(填字母)。A、高空排放 B、用于制备硫酸 C、用纯碱溶液吸收制Na2SO3 D、用浓硫酸吸收(3)、验证黄铜矿冶炼铜的反应所得气体中含有SO2的方法是。(4)、实验室制备、收集干燥的SO2 , 所需装置如图。

①装置A产生SO2 , 反应的化学方程式为。
②按气流方向连接各仪器接口,顺序为a→→→→→f,装置E中NaOH溶液的作用是吸收多余的SO2 , 该反应的离子方程式为。
18. 回答下列问题。(1)、Ⅰ.生物脱H2S的原理为:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4 2Fe2(SO4)3+2H2O
硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是。
(2)、由图1和图2判断使用硫杆菌的最佳条件为。 (3)、Ⅱ.一定温度下,某恒容密闭容器中含有NO2、N2O4两种气体,反应开始至达到平衡状态过程中,两种物质的浓度随时间的变化如图所示:
(3)、Ⅱ.一定温度下,某恒容密闭容器中含有NO2、N2O4两种气体,反应开始至达到平衡状态过程中,两种物质的浓度随时间的变化如图所示:
表示NO2浓度变化的曲线是 , 写出相应的化学方程式:。
(4)、从反应开始至达到平衡的过程中,用N2O4表示的反应速率v(N2O4)= , A、B两点对应状态中,曲线x代表的物质的反应速率相对大小为:v(A)v(B)。19. 回答下列问题。(1)、下列变化中属于吸热反应的是_______(填字母)A、液态水汽化 B、将胆矾加热变为白色粉末 C、苛性钠固体溶于水 D、生石灰跟水反应生成熟石灰(2)、断开1molH-H键、1molN-H键、1molN≡N键分别需要吸收的能量为436kJ、391kJ、946kJ,则1mol N2生成NH3理论上能(填“吸收”或“放出”)能量kJ。(3)、某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如表:序号
锌的质量/g
锌的状态
c(H2SO4)/mol·L-1
V(H2SO4)/mL
反应前溶液的温度/℃
其他试剂
1
0.65
粒状
0.5
50
20
无
2
0.65
粉末
0.5
50
20
无
3
0.65
粒状
0.5
50
20
2滴CuSO4溶液
4
0.65
粉末
0.8
50
20
无
5
0.65
粉末
0.8
50
35
2滴CuSO4溶液
在此5组实验中,速率最快的是(填实验序号);实验1和2表明对反应速率有影响;实验1和3表明对反应速率有影响。
(4)、用CH4和O2组合形成的燃料电池的结构如图丙:
则电极d是(填“正极”或“负极”),电池总反应式为。
20. 以下是关于化学反应2SO2+O2⇌2SO3的两个素材情景:素材1:某温度和压强下,2升密闭容器中,不同时间点测密闭体系中三种物质的物质的量

0
10
20
30
40
50
60
70
SO2
1
0.7
0.5
0.35
0.2
0.1
0.1
0.1
O2
0.5
0.35
0.25
0.18
0.1
0.05
0.05
0.05
SO3
0
0.3
0.5
0.65
0.8
0.9
0.9
0.9
素材2:反应在不同条件下进行时SO2的转化率:(SO2的转化率是反应的SO2占起始SO2的物质的量分数,SO2的转化率越大,化学反应的限度越大)

0.1 MPa
0.5 MPa
1 MPa
10 MPa
400 ℃
99.2
99.6
99.7
99.9
500 ℃
93.5
96.9
97.8
99.3
600 ℃
73.7
85.8
90.0
96.4
根据两个素材回答问题:
(1)、根据素材1中计算20~30s期间,用二氧化硫表示的化学反应速率为mol·L-1·s-1。(2)、根据素材2中分析得到,温度升高,SO2的转化率(选填“增大”、“不变”或“减小”);压强增大,SO2的转化率(选填“增大”、“不变”或“减小”)。(3)、在恒温恒容的密闭容器中,发生反应2SO2(g)+O2(g)⇌2SO3(g) , 当下列物理量不再发生变化时,一定能证明2SO2(g)+O2(g) ⇌2SO3(g)达到平衡状态的是(填序号)。①混合气体的压强 ②混合气体的密度
③混合气体的总物质的量 ④混合气体的平均相对分子质量