山西省柳林县2020-2021学年高二下学期化学期中考试试卷
试卷更新日期:2021-06-01 类型:期中考试
一、单选题
-
1. 下列表达方式正确的是( )A、24Cr 的外围电子排布式:3d44s2 B、CO2的立体结构模型
 C、基态碳原子的价电子排布图为
C、基态碳原子的价电子排布图为  D、N2 的电子式:
D、N2 的电子式:  2. 在基态多电子原子中,关于核外电子能量的叙述错误的是 ( )A、最易失去的电子能量最高 B、电离能最小的电子能量最高 C、p轨道电子能量一定高于s轨道电子能量 D、在离核最近区域内运动的电子能量最低3. 下列现象和应用与电子跃迁无关的是( )A、激光 B、焰色反应 C、原子光谱 D、燃烧放热4. 已知某元素的+2价离子的电子排布式为1s22s22p63s23p6 , 则该元素在周期表中属于( )A、第3周期ⅤB族 B、第4周期ⅡB族 C、第4周期Ⅷ族 D、第4周期ⅡA族5. 下列说法正确的是( )
2. 在基态多电子原子中,关于核外电子能量的叙述错误的是 ( )A、最易失去的电子能量最高 B、电离能最小的电子能量最高 C、p轨道电子能量一定高于s轨道电子能量 D、在离核最近区域内运动的电子能量最低3. 下列现象和应用与电子跃迁无关的是( )A、激光 B、焰色反应 C、原子光谱 D、燃烧放热4. 已知某元素的+2价离子的电子排布式为1s22s22p63s23p6 , 则该元素在周期表中属于( )A、第3周期ⅤB族 B、第4周期ⅡB族 C、第4周期Ⅷ族 D、第4周期ⅡA族5. 下列说法正确的是( )①电子云中的一个小黑点代表一个电子
②电子云密度大的地方,说明电子在核外空间单位时间内出现的机会多
③原子轨道是指原子运行的轨道
④s电子的电子云呈球形,p电子的电子云呈哑铃形
A、①② B、②③ C、③④ D、②④6. 下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是( )A、K、Na、Li B、Al、Mg、Na C、N、O、C D、Cl、S、P7. 若已发现了116号元素则下列推断正确的是:①其钠盐的化学式为Na2R ②其最高价氧化物对应的水化物的酸性比硫酸强 ③R是金属元素 ④R是非金属元素 ⑤最外电子层有6个电子( )A、①②③ B、①③⑤ C、②④⑤ D、③⑤8. 下列说法错误的是( )A、ns电子的能量可能低于(n-1)p电子的能量 B、6C的电子排布式 ,违反了洪特规则 C、电子排布式(22Ti)ls22s22p63s23p10违反了能量最低原理 D、电子排布式(22Ti)1s22s22p63s23p10违反了泡利不相容原理9. X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是( )A、Y原子的价层电子排布式为3s23p5 B、稳定性:Y的氢化物>Z的氢化物 C、第一电离能:Y<Z D、X、Y两元素形成的化合物为离子化合物10. 下列说法正确的是( )A、Na2O2和 NaOH 所含化学键类型完全相同 B、NH3比 PH3稳定是因为 NH3分子间存在氢键 C、CO2溶于水和干冰升华都只有分子间作用力改变 D、H2O2 是含非极性键的极性分子11. 下列分子中所有原子都满足最外层为8电子结构的是( )A、BF3 B、H2O C、SiCl4 D、PCl512. 下列关于物质性质的递变规律正确的是( )A、沸点:F2>Cl2>Br2>I2 B、稳定性:HF>H2O>NH3>CH4 C、酸性:HClO>HClO2> HClO3> HClO4 D、离子半径:Al3+> Mg2+> Na+13. 下列关于丙烯(CH3﹣CH═CH2)的说法中正确的( )A、丙烯分子中有 6 个 σ 键,1 个 π 键 B、丙烯分子中 3 个碳原子都是 sp3 杂化 C、丙烯分子属于极性分子 D、丙烯分子中 3 个碳原子在同一直线上14. 最近,中国科大的科学家们将 C60 分子组装在一单层分子膜表面,在-268℃时冻结分子的热振荡,并利用扫描隧道显微镜首次“拍摄”到能清楚分辨碳原子间单、双键的分子图像。下列化合物分子中一定 既含单键又含双键的是( )A、CO2 B、SO3 C、COCl2 D、H2O215. 374℃、22.1Mpa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH- , 由此可知超临界水( )A、显中性,pH等于7 B、表现出非极性溶剂的特性 C、显酸性,pH小于7 D、表现出极性溶剂的特性16. X、Y、Z是三种短周期元素,其中X、Y位于同一主族,Y、Z位于同一周期,X原子的最外层电子排布式是2s22p4 , Z原子的核外电子数比Y原子少1。下列说法错误的是( )A、CX2(C是原子核内含有6个质子的原子)分子是非极性分子 B、ZH3分子的立体构型为平面三角形 C、Z4分子是非极性分子 D、H2YO4的酸性比H3ZO4强17. 表中所列的字母分别代表某一种化学元素,下列说法正确的是( ) A、沸点A2D<A2X B、CA3分子是非极性分子 C、B、C、D形成的气态氢化物互为等电子体 D、C形成的单质中σ键与π键个数之比为1∶218. 下列对分子性质的解释中,错误的是( )
A、沸点A2D<A2X B、CA3分子是非极性分子 C、B、C、D形成的气态氢化物互为等电子体 D、C形成的单质中σ键与π键个数之比为1∶218. 下列对分子性质的解释中,错误的是( )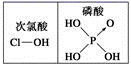 A、水很稳定(1000 ℃以上才会部分分解)是因为水中含有大量的氢键所致 B、乳酸(
A、水很稳定(1000 ℃以上才会部分分解)是因为水中含有大量的氢键所致 B、乳酸( )分子中含有一个手性碳原子
C、碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D、由上图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数
19. 某物质的实验式为PtCl4·2NH3 , 其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )A、配合物中中心原子的电荷数和配位数均为6 B、该配合物可能是平面正方形结构 C、Cl-和NH3分子均为Pt4+配体 D、配合物中Cl-与Pt4+配位,而NH3分子不配位20. X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是( )A、X元素的氢化物的水溶液显碱性 B、Z元素的离子半径大于W元素的离子半径 C、Z元素的单质在一定条件下能与X元素的单质反应 D、Y元素最高价氧化物的晶体具有很高的熔点和沸点
)分子中含有一个手性碳原子
C、碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D、由上图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数
19. 某物质的实验式为PtCl4·2NH3 , 其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )A、配合物中中心原子的电荷数和配位数均为6 B、该配合物可能是平面正方形结构 C、Cl-和NH3分子均为Pt4+配体 D、配合物中Cl-与Pt4+配位,而NH3分子不配位20. X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是( )A、X元素的氢化物的水溶液显碱性 B、Z元素的离子半径大于W元素的离子半径 C、Z元素的单质在一定条件下能与X元素的单质反应 D、Y元素最高价氧化物的晶体具有很高的熔点和沸点二、填空题
-
21. 应用 VSEPR 理论判断下表中分子或离子的立体构型。
分子
中心原子上孤电子对数
中心原子结合的杂化类型
分子或离子的立体构型
NH2-
BF3
H3O+
22. A、B、C、D 是同一周期的四种元素。A、B、C 的原子序数依次相差为 1,A 元素的单质的化学性质活泼,A元素的原子在本周期中第一电离能最小。B 元素的氧化物 2.0g 恰好跟100mL0.5mol·L−1硫酸完全反应。B 元素单质跟D元素单质反应生成化合物BD2。根据以上事实,填写下列空白:(1)、A的原子结构示意图: , C原子的电子式为;(2)、BD2的电子式为;若向C的氧化物的水化物中加入A的氧化物的水化物,则溶液显碱性。这一反应的离子方程式是。23. 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。(1)、W原子的核外电子排布式为。(2)、均由X、Y、Z三种元素组成的三种常见物质A.、B、C分别属于酸、碱、盐,其化学式依次为、、 , 推测盐中阴离子的空间构型为 , 其中心原子杂化方式为。(3)、Z、W两种元素电负性的大小关系为(填“大于”“等于”或“小于”);Y、Z两种元素第一电离能的大小关系为(填“大于”“等于”或“小于”)。24. A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型,C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:(1)、四种元素中电负性最大的是(填元素符号),其中C原子的外围电子排布图为。(2)、单质A有两种同素异形体,其中沸点高的是(填分子式),原因是 ;A和B的氢化物所含的化学键类型分别为和。(3)、C和D反应可生成组成比为1:3的化合物E,E的立体构型为 , 中心原子的杂化轨道类型为。(4)、化合物D2A的立体构型为 , 中心原子的价层电子对数为。25. 第四周期的 Cr、Fe、Co、Ni、Cu、Zn 等许多金属能形成配合物。(1)、NH3 是一种很好的配体,氨气分子是(填“极性”或“非极性”)分子,NH3 的沸 点(填“高于”“等于”或“低于”)AsH3。(2)、科学家通过 X 射线测得胆矾的结构示意图可简单表示如下:
图中虚线表示的作用力为。
(3)、胆矾溶液与氨水在一定条件下可以生成 Cu(NH3)4SO4•H2O 晶体。在 Cu(NH3)4SO4·H2O 晶体中,含 有的原子团或分子有:[Cu(NH3)4]2+、NH3、 SO42- 、H2O,[Cu(NH3)4]2+为平面正方形结构,则 VSEPR 模型为四面体结构的原子团或分子是 , 其中心原子的杂化轨道类型是 。(4)、金属镍粉在 CO 气流中轻微加热,生成无色挥发性液态 Ni(CO)4 , 呈正四面体构型。Ni(CO)4 易溶于 (填编号)。a . 水 b. 四氯化碳 c. 苯 d. 硫酸镍溶液