江苏省苏州市吴中区2020-2021学年高二下学期化学期中考试试卷
试卷更新日期:2021-06-01 类型:期中考试
一、单选题
-
1. “液态阳光”是指由阳光、二氧化碳和水通过人工光合作用得到的绿色液态燃料,下列有关“液态阳光”的说法错误的是( )A、 和 转化为“液态阳光”过程中同时释放能量 B、煤气化得到的水煤气合成的甲醇不属于“液态阳光” C、“液态阳光”行动有利于可持续发展并应对气候变化 D、“液态阳光”有望解决全球化石燃料不断枯竭的难题2. 炒过菜的铁锅未及时洗净(残液中含 ),不久便会因被腐蚀而出现红褐色锈斑,腐蚀原理如图所示,下列说法正确的是( )
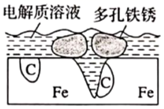 A、腐蚀过程中,负极是 ,发生电极反应: B、 失去电子经电解质溶液转移给C C、正极的电极反应式为 D、C是正极, 在C表面上发生还原反应3. 相同体积的溶液:稀硫酸溶液a, 醋酸溶液b, 氢氧化钠溶液c 三者的导电能力相同,若分别加入体积和物质的量浓度都相同的NaCl溶液后,它们的导电能力强弱顺序是( )A、b>a>c B、a=b=c C、c>a>b D、b>c=a4. 下列有关二氧化硫的说法正确的是( )A、SO2是非极性分子 B、SO2的水溶液能导电,所以SO2是电解质 C、SO2能使酸性高锰酸钾溶液褪色,说明SO2具有漂白性 D、少量的SO2添加到葡萄酒中是利用了其抑菌和抗氧化作用5. 二氧化硫制取三氧化硫的反应为 ,下列有关用二氧化硫制取三氧化硫的说法正确的是( )A、反应的 B、 与足量 反应,放出的热量为 C、工业上用通入足量的空气来提高 的转化率 D、反应中每消耗 转移的电子数目约等于6. 实验室用亚硫酸钠固体粉末与 70% 的硫酸制取少量的二氧化硫。图中装置能达到相应实验目的的是( )A、生成
A、腐蚀过程中,负极是 ,发生电极反应: B、 失去电子经电解质溶液转移给C C、正极的电极反应式为 D、C是正极, 在C表面上发生还原反应3. 相同体积的溶液:稀硫酸溶液a, 醋酸溶液b, 氢氧化钠溶液c 三者的导电能力相同,若分别加入体积和物质的量浓度都相同的NaCl溶液后,它们的导电能力强弱顺序是( )A、b>a>c B、a=b=c C、c>a>b D、b>c=a4. 下列有关二氧化硫的说法正确的是( )A、SO2是非极性分子 B、SO2的水溶液能导电,所以SO2是电解质 C、SO2能使酸性高锰酸钾溶液褪色,说明SO2具有漂白性 D、少量的SO2添加到葡萄酒中是利用了其抑菌和抗氧化作用5. 二氧化硫制取三氧化硫的反应为 ,下列有关用二氧化硫制取三氧化硫的说法正确的是( )A、反应的 B、 与足量 反应,放出的热量为 C、工业上用通入足量的空气来提高 的转化率 D、反应中每消耗 转移的电子数目约等于6. 实验室用亚硫酸钠固体粉末与 70% 的硫酸制取少量的二氧化硫。图中装置能达到相应实验目的的是( )A、生成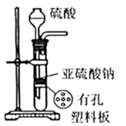 B、干燥
B、干燥 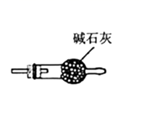 C、收集
C、收集  D、吸收 尾气
D、吸收 尾气  7. 在某一密闭容器中,若反应 达到平衡后,保持其温度不变,将该密闭容器的体积增加一倍,当达到新的平衡时,则下列说法正确的是( )A、容器内气体密度减小 B、平衡向正反应方向移动 C、二氧化氮的转化率增大 D、四氧化二氮的体积分数增大8. 金属镍有广泛的用途,粗镍中含有Fe、Zn、Cu、Pt等杂质,可用电解法制得高纯度的镍。下列叙述中正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )A、阳极发生还原反应,其电极反应式为Ni2++2e-=Ni B、电解过程中,阳极质量的减少量与阴极质量的增加量相等 C、电解后,溶液中存在的阳离子只有Fe2+和Zn2+ D、电解后,电解槽底部的阳极泥中有Cu和Pt9. 下列说法正确的是( )A、在相同温度下,物质的量浓度相等的氨水、 溶液, 相等 B、中和 和体积均相等的盐酸、 溶液,所需 的物质的量相同 C、室温下 的 溶液和 的 溶液中, D、浓度和体积都相等的盐酸和醋酸溶液分别与足量的 完全反应,盐酸产生的 多10.
7. 在某一密闭容器中,若反应 达到平衡后,保持其温度不变,将该密闭容器的体积增加一倍,当达到新的平衡时,则下列说法正确的是( )A、容器内气体密度减小 B、平衡向正反应方向移动 C、二氧化氮的转化率增大 D、四氧化二氮的体积分数增大8. 金属镍有广泛的用途,粗镍中含有Fe、Zn、Cu、Pt等杂质,可用电解法制得高纯度的镍。下列叙述中正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )A、阳极发生还原反应,其电极反应式为Ni2++2e-=Ni B、电解过程中,阳极质量的减少量与阴极质量的增加量相等 C、电解后,溶液中存在的阳离子只有Fe2+和Zn2+ D、电解后,电解槽底部的阳极泥中有Cu和Pt9. 下列说法正确的是( )A、在相同温度下,物质的量浓度相等的氨水、 溶液, 相等 B、中和 和体积均相等的盐酸、 溶液,所需 的物质的量相同 C、室温下 的 溶液和 的 溶液中, D、浓度和体积都相等的盐酸和醋酸溶液分别与足量的 完全反应,盐酸产生的 多10.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:

下列说法中正确的是( )
A、CO和O生成CO2是吸热反应 B、在该过程中,CO断键形成C和O C、CO和O生成了具有极性共价键的CO2 D、状态Ⅰ →状态Ⅲ表示CO与O2反应的过程11. 下列有关说法正确的是( )A、钢铁水闸可用牺牲阳极的阴极保护法或外加电流的阴极保护法进行保护 B、铜锌原电池中,盐桥中的 和 分别移向负极和正极 C、铅蓄电池放电时负极质量减轻,充电时阳极质量增加 D、在铁片上镀锌时,将铁片与电源的正极相连12. 全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法正确的是( )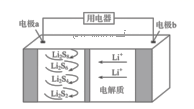 A、电池工作时,负极可发生反应:2Li2S6+2Li++2e-=3Li2S4 B、电池充电时间越长,电池中的Li2S2量越多 C、电解质中加入硫酸能增强导电性 D、电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g13. 乙烯的产量是衡量一个国家石油化工发展水平的重要标志。一定条件下CO2和H2合成乙烯的反应为2CO2(g) + 6H2(g)= 4H2O(g) + CH2=CH2(g) ΔH= a kJ∙mol-1。向恒容密闭容器中充入体积比为1:3的CO2和H2 , 测得不同温度下CO2的平衡转化率及催化剂的催化效率如图所示。下列有关说法正确的是( )
A、电池工作时,负极可发生反应:2Li2S6+2Li++2e-=3Li2S4 B、电池充电时间越长,电池中的Li2S2量越多 C、电解质中加入硫酸能增强导电性 D、电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g13. 乙烯的产量是衡量一个国家石油化工发展水平的重要标志。一定条件下CO2和H2合成乙烯的反应为2CO2(g) + 6H2(g)= 4H2O(g) + CH2=CH2(g) ΔH= a kJ∙mol-1。向恒容密闭容器中充入体积比为1:3的CO2和H2 , 测得不同温度下CO2的平衡转化率及催化剂的催化效率如图所示。下列有关说法正确的是( )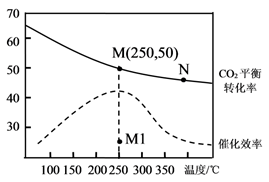 A、M点的平衡常数比N点的小 B、温度低于250℃时,乙烯的产率随温度升高而增大 C、保持N点温度不变,向容器中再充入一定量的H2 , CO2的转化率可能会增大到50% D、其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1点
A、M点的平衡常数比N点的小 B、温度低于250℃时,乙烯的产率随温度升高而增大 C、保持N点温度不变,向容器中再充入一定量的H2 , CO2的转化率可能会增大到50% D、其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1点二、综合题
-
14. 化学反应与能量变化是化学家研究的永恒话题。(1)、据报道,有科学家提出硅是“21世纪的能源”、“未来石油”的观点。
①硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,硅光电池是一种把能转化为能的装置。
②工业制备纯硅的反应: ,生成的 通入 的 溶液恰好反应,则制备纯硅的过程中(填“吸收或“释放”)的热量为 。
(2)、氢气是一种理想的绿色能源.请回答下列问题①在 下, 氢气完全燃烧生成液态水放出 的热量。写出表示氢气燃烧热的热化学方程式。
②氢能的存储是氢能利用的前提,科学家研究出一种储氢合金 ,已知:
;
则 。
(3)、化学能与电能的相互转换有着重要的用途。如图是一个化学过程的示意图.请回答下列问题。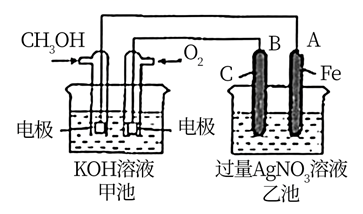
①乙池是装置(填“原电池”或“电解池”),A电极的名称是;B(石墨)电极的电极反应式为:。
②甲池中通入 一极的电极反应式为:。
③反应一段时间后,要使乙池反应后的溶液恢复到原来的状态,则需加入(填化学式)。
④研究证实,甲醇可由 在酸性水溶液中通过电解生成,则生成甲醇的电极反应式是:。
15. 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。(1)、在固定体积的密闭容器中,进行如下化学反应: 。该反应的化学平衡常数表达式是 .已知平衡常数K与温度T的关系如表:400
300
平衡常数K
①试判断 (填写“>”=”或“<”)。
②下列能说明该反应已达到平衡状态的是(请将答案填涂在答题卷相应位置)。
a.容器内 的浓度之比为
b.
c.容器内压强保持不变
d.混合气体的密度保持不变
e.断裂 的同时,有 生成
③合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是
a.采用较高温度 b.将生成的氨液化并及时从体系中分离出来
c.用铁触媒加快化学反应速率 d.采用较高压强
(2)、对反应 .在温度分别为 时,平衡体系中 的体积分数随压强变化曲线如图所示,下列说法正确的是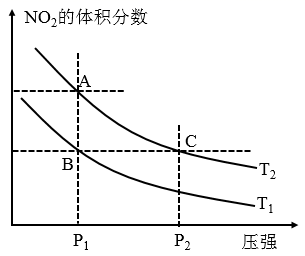
a. 两点的反应速率:
b. 两点的气体的平均相对分子质量:
c. 两点 的转化率:
d.由状态B到状态A,可以用加热的方法
(3)、反应 ,在合成塔中进行。图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 和水碳比 投料时二氧化碳转化率的情况。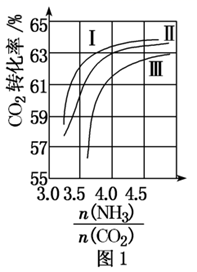
①曲线I、Ⅱ、Ⅲ水碳比的数值分别为A. ;B. ;C. 生产中应选用水碳比的数值为(填字母)。
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是。
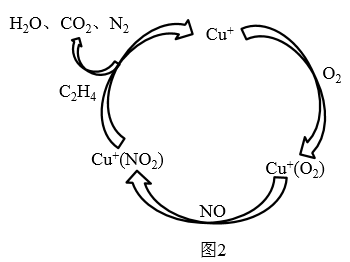
(4)、汽车使用乙醇汽油并不能减少 的排放,这使 的有效消除成为环保领域的重要课题。①目前,科学家正在研究一种以乙烯作为还原剂的脱硝 原理,其脱硝机理示意图如图2,按照机理写出该脱硝原理总反应的化学方程式:。
②某研究小组在实验室以 为催化剂,测得 转化为 的转化率随温度变化情况如图3所示。
若不使用 ,温度超过 ,发现 的分解率降低,其可能的原因是;在 的条件下,应控制的最佳温度在左右。
 16. 弱电解质的研究是重要课题。(1)、①已知不同 条件下,水溶液中碳元素的存在形态如图所示.下列说法错误的是
16. 弱电解质的研究是重要课题。(1)、①已知不同 条件下,水溶液中碳元素的存在形态如图所示.下列说法错误的是
a. 时,溶液中含碳元素的微粒主要是
b.A点,溶液中 和 浓度相同
c.当 时,
②向上述 的水溶液中加入 溶液时发生反应的离子方程式是。
(2)、 以及其它部分弱酸的电离平衡常数如表:弱酸
电离平衡常数
按要求回答下列问题:
① 的酸性由强到弱的顺序为。
②将少量 气体通入 溶液中,写出该反应的离子方程式:。
(3)、常温下,已知 一元酸 溶液中 。①常温下, 溶液的 ;
② 的 与 的 溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:。
17. 水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:I.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度,将水样与 碱性悬浊液(含有 )混合,反应生成 ,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化, 被 还原为 ,在暗处静置 ,然后用标准 溶液滴定,生成的 反应为: 。
回答下列问题:
(1)、取水样时应尽量避免扰动水体表面,这样操作的主要目的是。(2)、“氧的固定”中发生反应的化学方程式为。(3)、 被 还原为 的离子反应方程式。(4)、取 水样经固氧、酸化后,用 溶液滴定,以淀粉溶液作指示剂,终点现象为.若消耗 溶液的体积为 ,则水样中溶解氧的含量为 。(5)、上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏(填“高”或“低”)。