四川省遂宁市2021年高考化学三模试卷
试卷更新日期:2021-05-24 类型:高考模拟
一、单选题
-
1. 化学与生产、生活密切相关。下列说法错误的是( )A、我国成功研制出多款新冠疫苗,采用冷链运输疫苗,以防止蛋白质变性 B、北斗卫星导航系统由中国自主研发、独立运行,其所用芯片的主要成分为SiO2 C、5G技术的发展,推动了第三代半导体材料氮化镓等的应用,镓为门捷列夫所预测的“类铝”元素 D、石墨烯液冷散热技术系我国华为公司首创,所使用材料石墨烯是一种二维碳纳米材料2. 奎宁,俗称金鸡纳霜,又称为金鸡纳碱,其结构如图。下列关于奎宁的说法错误的是( )
 A、金鸡纳霜属于芳香族化合物,既能发生取代反应又能发生消去反应 B、金鸡纳霜既能使溴水褪色,又能使酸性高锰酸钾溶液褪色 C、金鸡纳霜既能与盐酸反应,又能与NaOH溶液反应 D、金鸡纳霜的同分异构体既有酯类又有羧酸类3. 已知NA为阿伏加德罗常数的值,下列叙述正确的是( )A、12 g石墨烯(单层石墨)中含有六元环的个数为2NA B、100g质量分数为46%的乙醇水溶液中含有的氧原子数为NA C、在0.1mol/L的Na2CO3溶液中,阴离子总数一定大于0.1NA D、常温下,1L 0.1mol·L-1醋酸钠溶液中加入醋酸至溶液为中性,则溶液含醋酸根离子数0.1NA4. 车发动机在稀燃和富燃条件下交替进行,将尾气中的NOx在催化剂上反应脱除。其工作原理示意图如下:
A、金鸡纳霜属于芳香族化合物,既能发生取代反应又能发生消去反应 B、金鸡纳霜既能使溴水褪色,又能使酸性高锰酸钾溶液褪色 C、金鸡纳霜既能与盐酸反应,又能与NaOH溶液反应 D、金鸡纳霜的同分异构体既有酯类又有羧酸类3. 已知NA为阿伏加德罗常数的值,下列叙述正确的是( )A、12 g石墨烯(单层石墨)中含有六元环的个数为2NA B、100g质量分数为46%的乙醇水溶液中含有的氧原子数为NA C、在0.1mol/L的Na2CO3溶液中,阴离子总数一定大于0.1NA D、常温下,1L 0.1mol·L-1醋酸钠溶液中加入醋酸至溶液为中性,则溶液含醋酸根离子数0.1NA4. 车发动机在稀燃和富燃条件下交替进行,将尾气中的NOx在催化剂上反应脱除。其工作原理示意图如下:
下列说法错误的是( )
A、稀燃过程中,Pt作催化剂,NO与氧气反应生成NO2 B、稀燃过程中,NO2与BaO反应可能生成NO和Ba(NO3)2 C、富燃过程中,Pt催化下NO2被CO还原的反应为:2NO2+4CO N2+4CO2 D、富燃过程中,还原产物为N2和CO25. 根据实验操作及现象推出的结论一定正确的是( )选项
操作
现象
解释或结论
A
向某无色溶液中通入过量的CO2气体
有白色沉淀产生
该溶液中一定含SiO
B
向淀粉溶液中加入适量20%H2SO4溶液,加热,冷却后加入NaOH溶液至碱性,加入少量碘水
溶液未变蓝
淀粉已完全水解
C
将带火星的木条和加热至液态的钠分别伸入盛有NO2的集气瓶中
木条不复燃,钠燃烧
NO2的助燃性具有选择性
D
向某溶液里滴加NaOH溶液并将湿润的红色石蕊试纸置于试管口
试纸颜色无明显变化
原溶液中无NH
A、A B、B C、C D、D6. 乙二胺(H2NCH2CH2NH2)是二元弱碱,H2A是二元弱酸。下图既可表示常温下乙二胺溶液中含氮微粒的百分含量δ (即物质的量百分数)随溶液pH的变化曲线,又可表示常温下H2A溶液中H2A、HA-、A2-微粒的百分含量δ随溶液pH的变化曲线。
已知:H2NCH2CH2NH2+H2O⇌[H2NCH2CH2NH3]++OH-
下列说法正确的是( )
A、曲线c表示H2NCH2CH2NH2或H2A的百分含量δ随溶液pH的变化情况 B、乙二胺的Kb2=10-9.93 C、[H3NCH2CH2NH2][HA]溶液中各离子浓度大小关系为:c([H3NCH2CH2NH2] +)=c(HA-)>c(H2NCH2CH2NH2)=c(A2-)>c(H+)=c(OH-) D、一定浓度的[H3NCH2CH2NH3]Cl2溶液中存在关系式:2c([H2NCH2CH2NH2])+c([H3NCH2CH2NH2]+)=c(H+)-c(OH-)7. 一种由短周期元素组成的化合物,其结构如图所示。X、Y、Z、Q、R位于同一周期原子序数依次递增,Z、Q的核电荷数之和等于R的最外层电子数的2倍。下列错误的是( ) A、Y和R形成的化合物中各原子最外层均满足8电子稳定结构 B、原子半径:X>Z>Q>R C、元素的非金属性:Z<Q<R D、化合物存在离子键和共价键
A、Y和R形成的化合物中各原子最外层均满足8电子稳定结构 B、原子半径:X>Z>Q>R C、元素的非金属性:Z<Q<R D、化合物存在离子键和共价键二、综合题
-
8. 2-硝基-1,3-苯二酚是重要的医药中间体。实验室常以间苯二酚为原料,经磺化、硝化、去磺酸基三步合成:
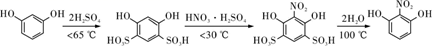
部分物质相关性质如下表:
名称
相对分子质量
性状
熔点/℃
水溶性(常温)
间苯二酚
110
白色针状晶体
110.7
易溶
2-硝基-1,
3-苯二酚
155
桔红色针状晶体
87.8
难溶
制备过程如下:
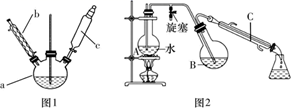
第一步:磺化。称取77.0 g间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内搅拌15 min(如图1)。
第二步:硝化。待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅拌15 min。
第三步:蒸馏。将硝化反应混合物的稀释液转移到圆底烧瓶B中,然后用如图2所示装置进行水蒸气蒸馏(水蒸气蒸馏可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的),收集馏出物,得到2-硝基-1,3-苯二酚粗品。
请回答下列问题:
(1)、图1中仪器a的名称是;磺化步骤中控制温度最合适的范围为(填字母代号,下同)。A.30~60℃ B.60~65℃
C.65~70℃ D.70~100℃
(2)、已知:酚羟基邻对位的氢原子比较活泼,均易被取代。请分析第一步磺化引入磺酸基基团(—SO3H)的作用是。(3)、硝化步骤中制取“混酸”的具体操作是。(4)、水蒸气蒸馏是分离和提纯有机物的方法之一,被提纯物质必须具备的条件正确的是___________。A、具有较低的熔点 B、不溶或难溶于水,便于最后分离 C、难挥发性 D、在沸腾下与水不发生化学反应(5)、下列说法正确的是___________。A、直型冷凝管内壁中可能会有红色晶体析出 B、反应一段时间后,停止蒸馏,先熄灭酒精灯,再打开旋塞,最后停止通冷凝水 C、烧瓶A中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能防止压强过小引起倒吸(6)、蒸馏所得2-硝基-1,3-苯二酚中仍含少量杂质,可用少量乙醇水混合剂洗涤。请设计简单实验证明2-硝基-1,3-苯二酚已经洗涤干净。(7)、本实验最终获得15.5 g桔红色晶体,则2-硝基-1,3-苯二酚的产率约为(保留3位有效数字)。9. 以含锂的电解铝废渣(主要含AlF3、NaF、LiF、CaO)和浓硫酸为原料,制备电池级碳酸锂,同时得到副产品冰晶石的工艺流程如下:
已知:LiOH易溶于水,Li2CO3微溶于水。回答下列问题:
(1)、加快酸浸速率的方法有 , 电解铝废渣与浓硫酸反应产生的气体的化学式为。苛化反应过程中加入氧化钙将碳酸锂转化为氢氧化锂溶液,若氧化钙过量则可能造成。(2)、碱解反应中,同时得到气体和沉淀,反应的离子方程式为。(3)、一般地说K>105时,该反应就基本进行完全了。苛化反应中存在如下平衡:Li2CO3(s)+ Ca2+(aq) 2Li+(aq)+CaCO3(s),通过计算说明该反应是否进行完全:[已知Ksp(Li2CO3)=8.64×10-4、Ksp(CaCO3)=2.5×10-9]。(4)、由碳化反应后的溶液得到Li2CO3 的具体实验操作有:加热浓缩, , 过滤, , 干燥。(5)、上述流程得到的副产品冰晶石的化学方程式(6)、电池级Li2CO3可由高纯度LiOH转化而来。将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式为。10. 科学家们致力于消除氮氧化物对大气的污染。回答下列问题:(1)、NO在空气中存在如下反应:2NO(g)+O2(g) ⇌2NO2(g) ΔH , 该反应共有两步第一步反应为2NO(g) ⇌N2O2(g) ΔH1<0;请写出第二步反应的热化学方程式(ΔH2用含ΔH、ΔH1的式子来表示):。(2)、温度为T1时,在两个容积均为1 L的恒容密闭容器中仅发生反应: 2NO2(g) ⇌2NO(g)+O2(g),容器I中5min达到平衡。相关数据如表所示:容器编号
物质的起始浓度(mol/L)
物质的平衡浓度(mol/L)
c(NO2)
c(NO)
c(O2)
c(O2)
I
0.6
0
0
0.2
Ⅱ
0.3
0.5
0.2
①容器Ⅱ在反应的起始阶段向(“正反应”、“逆反应”、“达平衡”)方向进行。
②达到平衡时,容器I与容器Ⅱ中的总压强之比为
A.>1 B.=1 C.<1
(3)、NO2存在如下平衡:2NO2(g) ⇌N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:υ(NO2)=k1·P2(NO2),υ(N2O4)=k2·P(N2O4),相应的速率与其分压关系如图所示。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=。 (4)、可用NH3去除 NO,其反应原理4NH3+6NO=5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为 4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示:
(4)、可用NH3去除 NO,其反应原理4NH3+6NO=5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为 4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示:
①曲线a中,NO的起始浓度为6×10-4 mg·m-3 , 从A点到B点经过0.8 s,该时间段内NO的脱除速率为mg/(m3·s)。
②曲线b对应NH3与NO的物质的量之比是。
(5)、还可用间接电解法除NO。其原理如图所示:
①从A口中出来的物质的是。
②写出电解池阴极的电极反应式。
③用离子方程式表示吸收池中除去NO的原理。
11. 在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了Fe、Co、Ni、C等多种元素。请回答:(1)、基态铁的价电子排布式为 , 基态Ni原子的电子空间运动状态有种。(2)、Ni(CO)4常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4是分子(填“极性”或“非极性”)。(3)、实验室常用 KSCN溶液检验 。①与KSCN中与SCN-互为等电子体的非极性分子的化学式为
②SCN-中碳原子杂化类型为。
(4)、配位化合物[Co(NH3)5Cl]Cl2中心原子Co的配位数为 , 配位原子为。1mol[Co(NH3)5Cl]Cl2中σ键mol。(5)、已知Ni可以形成多种氧化物,其中一种NixO晶体的晶胞结构为NaCl型,由于晶体缺陷导致x=0.88,晶胞参数为a nm,则晶体密度为g·cm-3(NA 表示阿伏加德罗常数的值,只需列出表达式)。12. 福酚美克是一种影响机体免疫力功能的药物,可通过以下方法合成:
回答下列问题:
(1)、物质D中含氧官能团的名称为;C→D的转化属于反应(填反应类型)。A与足量NaOH溶液反应的方程式:。(2)、上述流程中设计A→B步骤的目的是;(3)、D与银氨溶液发生反应的化学方程式为。(4)、福酚美克具有多种同分异构体。出其中一种符合下列条件的有机物结构简式:。①含有-CONH2;②能与FeCl3溶液发生显色反应;③核磁共振氢谱的吸收峰数目有4个。
(5)、参照上述合成路线和信息,以乙醇为原料(无机试剂任选),设计制取如图物质( )的合成路线:。
)的合成路线:。