四川省泸州市高2021年高考化学二模试卷
试卷更新日期:2021-05-24 类型:高考模拟
一、单选题
-
1. 2020年6月23日西昌卫星发射中心用长征三号乙运载火箭,成功发射北斗系统第五十五颗导航卫星。下列有关说法错误的是( )A、火箭上用的碳纤维复合材料属于碳的同素异形体单质 B、火箭燃料发生氧化还原反应将化学能转化为势能、动能、热能 C、铝合金做飞行器的材料是利用其质轻强度大的性能 D、卫星计算机芯片使用的是高纯度的硅2. 阿比朵尔是李兰娟团队公布治疗新型冠状肺炎的最新研究成果,可有效抑制病毒,结构如图。下列有关阿比朵尔的说法中正确的是( )
 A、阿比朵尔为芳香烃 B、所有碳原子一定处于同一平面 C、能发生水解、取代和加成反应 D、一个阿比朵尔分子中含有21个碳原子3. 已知X、Y、Z、W、R是原子序数依次增大的五种短周期主族元素,只有Z是金属元素,X的简单氢化物分子为正四面体结构,Y是地壳中含量最高的元素,Y与W同主族,下列说法正确的是( )A、原子半径:X<Y<W B、最高价氧化物的水化物的酸性: X<W<R C、WY2能使紫色石蕊试液先变红后褪色 D、Z与Y形成的化合物一定是碱性氧化物4. NA为阿伏加德罗常数的值,下列说法正确的是( )A、12g C所含的原子数为阿伏加德罗常数 B、O2的相对分子质量为32,所以O2的摩尔质量也为32。 C、标准状况下,1molNO 与11.2L O2充分反应后分子总数为NA D、P4为正四面体形分子,则1 mol P4分子中含有6NA个共价键5. 下列有关实验错误的是( )A、中和反应反应热的测定,需要准确读取酸碱溶液混合后的最高温度 B、将4.0g NaOH置于100mL容量瓶中,加水配制1.000mo/LNaOH溶液 C、除去甲烷中的乙烯,可以依次通过酸性KMnO4溶液、NaOH溶液、浓H2SO4 D、探究Fe2+能转化为Fe3+ , 可以向FeCl2溶液中依次滴加KSCN溶液、氯水6. 溶液中的离子平衡是以化学平衡理论为基础,以探讨离子反应原理的基础性理论。常温下,下列有关说法错误的是( )A、10mL pH=3的醋酸溶液稀释至100 mL,稀释后溶液的pH<4。 B、HF溶液中滴加少量稀NaOH溶液, 的值不变 C、Na2C2O4溶液中存在的离子浓度关系c(OH -)=c( HC2O )+c(H2C2O4)+c(H+) D、反应3Mg(OH)2(s)+ 2Fe3+=2Fe(OH)3 (s)+ 3Mg2+的平衡常数K=7. 已知Fe2+与H2O2溶液混合发生Fenton反应生成氧化性很强的羟基自由基(•OH),可将CN-氧化为低毒的CNO- , 实现废水处理的目的。三维电极电解-Fenton反应处理废水的原理如图所示,多孔焦炭电极将整个电解槽变成了许多微电解池。下列说法错误的是( )
A、阿比朵尔为芳香烃 B、所有碳原子一定处于同一平面 C、能发生水解、取代和加成反应 D、一个阿比朵尔分子中含有21个碳原子3. 已知X、Y、Z、W、R是原子序数依次增大的五种短周期主族元素,只有Z是金属元素,X的简单氢化物分子为正四面体结构,Y是地壳中含量最高的元素,Y与W同主族,下列说法正确的是( )A、原子半径:X<Y<W B、最高价氧化物的水化物的酸性: X<W<R C、WY2能使紫色石蕊试液先变红后褪色 D、Z与Y形成的化合物一定是碱性氧化物4. NA为阿伏加德罗常数的值,下列说法正确的是( )A、12g C所含的原子数为阿伏加德罗常数 B、O2的相对分子质量为32,所以O2的摩尔质量也为32。 C、标准状况下,1molNO 与11.2L O2充分反应后分子总数为NA D、P4为正四面体形分子,则1 mol P4分子中含有6NA个共价键5. 下列有关实验错误的是( )A、中和反应反应热的测定,需要准确读取酸碱溶液混合后的最高温度 B、将4.0g NaOH置于100mL容量瓶中,加水配制1.000mo/LNaOH溶液 C、除去甲烷中的乙烯,可以依次通过酸性KMnO4溶液、NaOH溶液、浓H2SO4 D、探究Fe2+能转化为Fe3+ , 可以向FeCl2溶液中依次滴加KSCN溶液、氯水6. 溶液中的离子平衡是以化学平衡理论为基础,以探讨离子反应原理的基础性理论。常温下,下列有关说法错误的是( )A、10mL pH=3的醋酸溶液稀释至100 mL,稀释后溶液的pH<4。 B、HF溶液中滴加少量稀NaOH溶液, 的值不变 C、Na2C2O4溶液中存在的离子浓度关系c(OH -)=c( HC2O )+c(H2C2O4)+c(H+) D、反应3Mg(OH)2(s)+ 2Fe3+=2Fe(OH)3 (s)+ 3Mg2+的平衡常数K=7. 已知Fe2+与H2O2溶液混合发生Fenton反应生成氧化性很强的羟基自由基(•OH),可将CN-氧化为低毒的CNO- , 实现废水处理的目的。三维电极电解-Fenton反应处理废水的原理如图所示,多孔焦炭电极将整个电解槽变成了许多微电解池。下列说法错误的是( )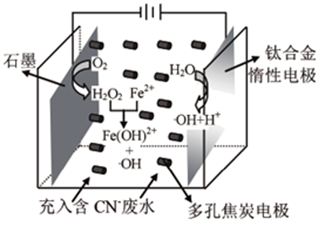 A、钛合金电极反应式为2H2O- 2e- =2H++2•OH B、阴极电极反应式为O2+ 2H++ 2e - = H2O2 C、焦炭电极表面能产生•OH使废水处理效率提高 D、Fe(OH)2+能在钛合金电极实现再生循环利用
A、钛合金电极反应式为2H2O- 2e- =2H++2•OH B、阴极电极反应式为O2+ 2H++ 2e - = H2O2 C、焦炭电极表面能产生•OH使废水处理效率提高 D、Fe(OH)2+能在钛合金电极实现再生循环利用二、综合题
-
8. 乙酸正丁酯,为无色透明有愉快果香气味的液体,是一种优良的有机溶剂和有机合成中间体,实验室制备原理为:CH3COOH+CH3(CH2)OH CH3COO(CH2)3CH3+H2O,装置如图所示(夹持装置已略去),实验步骤如下:
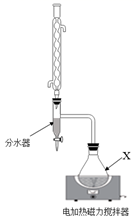
I.向100mL反应容器X中,加18.5g正丁醇,16.8g 冰醋酸,1gKHSO4 , 混匀,加2粒沸石。接上冷凝管和分水器。
II.加热反应开始后,控制回流速度1~ 2滴/s,大约40 min后,反应完成,停止加热。
III.分离提纯产品。过滤回收KHSO4 , 将滤液和分水器分出的酯层一起倒入分液漏斗中,用10 mL水洗涤; ……蒸馏得到产品29.0 mL。
已知:
名称
相对分子质量
溶解性
密度(g/cm3)
沸点(℃)
正丁醇
74
稍溶于水和易溶于有机溶剂
0.81
117.7
冰醋酸
60
能溶于水和有机溶剂
1.05
117.9
乙酸正丁酯
116
难溶于水
0.90.
126.5 .
回答下列问题:
(1)、图中仪器X的名称是 , KHSO4的作用是。(2)、用过量乙酸的目的是。(3)、本实验中分水器的作用是。 实验中需先在分水器中加水,使水面稍低于支管口1~2cm,并保持水面上仅有很浅一层油层存在,直至反应完成。这样操作的目的是。(4)、步骤III中第一次水洗主要除去的是。步骤III“……”。处还需要经过以下一系列的操作提纯,其正确的顺序是。a.再用10mL水洗涤; b.用无水硫酸镁干燥;
c.用10 mL 10%Na2CO3洗涤; d.过滤
(5)、下列蒸馏装置最合适的是(填选项字母) ;本实验中乙酸正丁酯的产率为 9. 钴可用于火箭发动机、导弹的耐热部件以及原子能工业。下图是由铜钴精矿提取钴的相关工业流程。铜钴精矿中主要含氧化铜、硫化钴(CoS)和少量FeS等。
9. 钴可用于火箭发动机、导弹的耐热部件以及原子能工业。下图是由铜钴精矿提取钴的相关工业流程。铜钴精矿中主要含氧化铜、硫化钴(CoS)和少量FeS等。
已知:在pH为4~6时Fe3+水解生成Fe(OH)3•2nFe3+•3(n-x)SO 胶体,具有吸附性。
(1)、从“氨浸”可知,Cu2+、 Fe2+、Co2+三者中易于形成氨合物的离子是 ;含Cu(NH3) 的溶液“电解”阴极反应式为。(2)、“酸浸”中硫化钴(CoS) 、Na2SO3与盐酸共同反应的离子方程式为。(3)、“除铁”加入了试剂X,使Fe2+转化为Fe3+ , 则试剂X最好选用___________ ( 填字母编号)。A、KMnO4溶液 B、H2O2溶液 C、HNO3 D、SO2(4)、“ 萃取”是利用某磷酸酯P50 (用RH表示)萃取钴,其反应的离子方程式为。(5)、整个流程中可以循环利用的物质有。(6)、“除铁”中,溶液pH对钴回收影响密切,如下图所示该步应控制pH范围为 , pH较大时钴回收率骤降的原因是。(已知Co2+沉淀的pH为6.7~8.7)。 10. 消除城市中汽车尾气的污染是一个很重要的课题。回答下列问题(1)、下列不属于汽车尾气中的污染物的是___________A、CO、CxHy B、NOx、细颗粒物 C、CO、NOx D、CO2、H2S(2)、已知:① 2NO(g) + 2CO(g) N2(g) + 2CO2(g) ∆H1=-746.5 kJ• mol-1 , 据此可在一定条件下反应消除NO和CO的污染;② CO2(g)+C(s)=2CO(g) △H2=+172.5 kJ•mol-1;碳(石墨)的燃烧热为-393.5kJ•mol-1.写出石墨完全燃烧的热化学方程式。2NO(g)= N2(g)+O2(g) △H3=kJ•mol-1(3)、某研究小组在三个容积均为VL的恒容密闭容器中,分别充入1.0molNO和1.0molCO,在三种不同实验条件(见下表)下进行上述反应,反应体系的总压强(P)随时间变化情况如图所示:
10. 消除城市中汽车尾气的污染是一个很重要的课题。回答下列问题(1)、下列不属于汽车尾气中的污染物的是___________A、CO、CxHy B、NOx、细颗粒物 C、CO、NOx D、CO2、H2S(2)、已知:① 2NO(g) + 2CO(g) N2(g) + 2CO2(g) ∆H1=-746.5 kJ• mol-1 , 据此可在一定条件下反应消除NO和CO的污染;② CO2(g)+C(s)=2CO(g) △H2=+172.5 kJ•mol-1;碳(石墨)的燃烧热为-393.5kJ•mol-1.写出石墨完全燃烧的热化学方程式。2NO(g)= N2(g)+O2(g) △H3=kJ•mol-1(3)、某研究小组在三个容积均为VL的恒容密闭容器中,分别充入1.0molNO和1.0molCO,在三种不同实验条件(见下表)下进行上述反应,反应体系的总压强(P)随时间变化情况如图所示:
实验编号
a
b
c
温度/K
500
500
600
催化剂的比表面积/m2.g-1
82
124
124
①曲线III对应的实验编号是 , 曲线I中压强降低的原因是。
②由曲线II数据计算出对应条件下的压强平衡常数Kp= ; 若在曲线III对应条件下,NO、CO、N2、 CO2的分压依次是10kPa、20kPa、 40kPa、 40kPa,则此时反应的速率v正 v逆(填 “<”、=’或“>”)。
(4)、反应物分子一步直接转化为产物的反应称为基元反应,一个化学反应往往是由多个基元反应分步进行的,这个分步过程称为反应机理,机理中的快反应对整个反应速率的影响可以忽略不计。一定温度下,基元反应的化学反应速率与反应物浓度以其化学计量数的幂的连乘积成正比,如基元反应mA(g)+nB(g) pC(g)的 “速率方程”可表示为v= kcm(A)•cn(B) (k为速率常数)。实验测得低温时某反应的速率方程为v=kc2(NO2),其反应机理有如下两种可能。则该反应的化学方程式可表示为 , 以 下机理中与其速率方程符合的是 ( 填编号)。反应机理
第一步反应
第二步反应
①
2NO =N2O4 (快反应)
N2O4+2CO= 2NO+2CO2 (慢反应)
②
2NO2=NO3+NO (慢反应)
NO3+CO=NO2+CO2 (快反应)
11. 第IVA元素在地壳中含量丰富,在人类生活各方面都有广泛的应用。回答下列问题。(1)、基态C原子中填充了电子的原子轨道共有个,基态Si原子的价电子电子排布式为 , 第 一电离能C Ge (填“大于”、“小于”或“等于”)。(2)、X是碳的一种氧化物,X的五聚合体结构如图1所示。则X的分子式为 ; X分子中每个原子都满足最外层8电子结构,X分子的电子式为。X的沸点CO2的沸点(填“大于”、“小于” 或“等于”) (3)、C20分子是由许多正五边形构成的空心笼状结构如图2所示,分子中每个碳原子只跟相邻的3个碳原子形成化学键。则C20分子中含个 σ键, 请你大胆猜测:C20 分子中碳原子的杂化轨道为(4)、β-SiC晶胞如图3所示,若碳和硅的原子半径分别为a pm和b pm,密度为 g/cm3 , 其原子的空间利用率( 即晶胞中原子体积占空间体积的百分率)为(用含a、b、p、NA的代数式表示,NA表示阿伏加德罗常数的值)。12. 磷酸氯喹是一种抗疟疾药物,经研究发现该药在体外细胞水平上对新型冠状病毒具有抑制作用。其中氣喹的一种合成路线如下图。
(3)、C20分子是由许多正五边形构成的空心笼状结构如图2所示,分子中每个碳原子只跟相邻的3个碳原子形成化学键。则C20分子中含个 σ键, 请你大胆猜测:C20 分子中碳原子的杂化轨道为(4)、β-SiC晶胞如图3所示,若碳和硅的原子半径分别为a pm和b pm,密度为 g/cm3 , 其原子的空间利用率( 即晶胞中原子体积占空间体积的百分率)为(用含a、b、p、NA的代数式表示,NA表示阿伏加德罗常数的值)。12. 磷酸氯喹是一种抗疟疾药物,经研究发现该药在体外细胞水平上对新型冠状病毒具有抑制作用。其中氣喹的一种合成路线如下图。
已知: A.
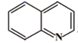 和
和  属于芳香族化合物,其芳香环结构与苯环结构相似;
属于芳香族化合物,其芳香环结构与苯环结构相似;B. R2NH+ClR'→R2NR'+ HCl (R为烃基或氢原子,R'为烃基)
回答下列问题:
(1)、化合物A的名称是 ,化合物C中的官能团名称是。(2)、反应①类型是 ,G最多有 个原子共平面,E与F相对分子质量差值为。(3)、符合下列条件的C的同分异构体共种(不包括C),其中核磁共振氢谱有3个吸收峰的物质的结构简式是。①具有六元芳香环状结构;②不含—N—Cl 结构。
(4)、哌啶 )能与1,2-二氯乙烷合成二哌啶乙烷(C12H24N2) ,该反应的化学方程式为。
)能与1,2-二氯乙烷合成二哌啶乙烷(C12H24N2) ,该反应的化学方程式为。