上海长宁区2021年高考化学二模试卷
试卷更新日期:2021-05-24 类型:高考模拟
一、单选题
-
1. 据报道,75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活新型冠状病毒。对于上述化学药品的说法错误的是( )A、 能与水互溶 B、 通过氧化灭活病毒 C、过氧乙酸与乙酸是同系物 D、氯仿又叫三氯甲烷2. 金属铁在一定条件下与下列物质作用时只能变为+2 价铁的是( )A、FeCl3 B、HNO3 C、Cl2 D、O23. 合成氨工业上,采用氮氢循环操作的主要目的是( )A、加快反应速率 B、提高氨气的平衡浓度 C、提高氮气和氢气的利用率 D、降低氨气的沸点4. 卤族元素有关性质比较正确的是( )A、稳定性:HF>HCl>HBr>HI B、氧化性:F2<Cl2<Br2<I2 C、熔沸点:F2>Cl2>Br2>I2 D、还原性:F﹣>Cl﹣>Br﹣>I﹣5. 已知 熔融状态下能导电。关于 晶体的分析错误的是( )A、是强电解质 B、存在两种化学键 C、是离子晶体 D、阴阳离子个数比为20∶16. 能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是( )A、点燃,能燃烧的是矿物油 B、加入足量氢氧化钠溶液共热,不分层的是地沟油 C、加入水中,浮在水面上的是地沟油 D、测定沸点,有固定沸点的是矿物油7. 某晶体中含有极性键,关于该晶体的说法错误的是( )A、不可能有很高的熔沸点 B、不可能是单质 C、可能是有机物 D、可能是离子晶体8. 化学与生活密切相关。下列说法正确的是( )A、燃煤中加入CaO可以减少温室气体的排放 B、合金材料中可能含有非金属元素 C、14C可用于文物年代的鉴定,14C与12C互为同素异形体 D、碳酸钡可用于胃肠X射线造影检查9. 利用下图装置进行实验,烧杯中不会出现沉淀的是( )
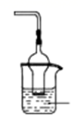
A
B
C
D
气体
硫化氢
二氧化碳
氨气
氯化氢
溶液
亚硫酸
氯化钙
氯化铝
硝酸银
A、A B、B C、C D、D10. 检验硫酸铁溶液中是否含有硫酸亚铁,可选用的试剂是( )A、NaOH 溶液 B、酸性 KMnO4 溶液 C、KSCN 溶液 D、Cu11. 具有下列性质的物质可能属于离子晶体的是( )
A、熔点113 ℃,能溶于CS2 B、熔点44℃,液态不导电 C、熔点1124℃,易溶于水 D、熔点180 ℃,固态能导电12. 将等量的固体Mg(OH)2 , 置于等体积的下列液体中,最终固体剩余最少的是( )A、在纯水中 B、在0.1mol/L的MgCl2溶液中 C、在0.1mol/L的NH3·H2O中 D、在0.1mol/L的CH3COOH溶液中13. 硒是人体必需的微量元素,图是硒在周期表中的信息,关于硒元素的说法错误的是( )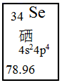 A、位于第四周期 B、质量数为34 C、原子最外层有6个电子 D、相对原子质量为78.9614. 关于硫酸工业中的催化氧化反应,可以用勒夏特列原理解释的是( )A、通入过量氧气 B、选择V2O5做催化剂 C、选择常压条件 D、升温至450℃左右15. 把镁条(去除氧化膜)投入到盛有盐酸的敞口容器中,产生H2的速率v与时间t的关系如下图所示,其中影响AB段速率的主要因素是( )
A、位于第四周期 B、质量数为34 C、原子最外层有6个电子 D、相对原子质量为78.9614. 关于硫酸工业中的催化氧化反应,可以用勒夏特列原理解释的是( )A、通入过量氧气 B、选择V2O5做催化剂 C、选择常压条件 D、升温至450℃左右15. 把镁条(去除氧化膜)投入到盛有盐酸的敞口容器中,产生H2的速率v与时间t的关系如下图所示,其中影响AB段速率的主要因素是( )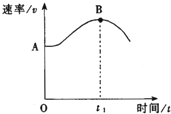 A、H+的浓度 B、体系的压强 C、溶液的温度 D、Cl-的浓度16. 紫花前胡酵
A、H+的浓度 B、体系的压强 C、溶液的温度 D、Cl-的浓度16. 紫花前胡酵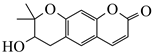 可从中药材当归和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是( ) A、分子式为 B、不能使溴水变色 C、能够发生水解反应 D、能够发生消去反应生成双键17. 下列操作会使相应溶液pH增大的是( )A、 溶液中再加入 B、 溶液加热 C、氨水中加入少量 固体 D、醋酸溶液加热18. 对于下列实验,能正确描述其反应的离子方程式是( )A、同浓度同体积 溶液与 溶液混合: B、同浓度同体积 溶液与 溶液混合: C、向 溶液中滴加少量 : D、用 溶液吸收少量 :19. 对金属腐蚀及防护的表述正确的是( )A、金属腐蚀的本质:金属失电子发生还原反应 B、牺牲阳极的阴极保护法:被保护的金属应做负极 C、外加电流阴极保护法:被保护的金属应与电源正极相连 D、钢铁表面烤蓝生成一层致密的 ,能起到防腐蚀作用20. 用物质的量都是 的 和 配成1升混合溶液,已知其中 ,对该溶液的下列判断正确的是( )A、 B、 C、 D、
可从中药材当归和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是( ) A、分子式为 B、不能使溴水变色 C、能够发生水解反应 D、能够发生消去反应生成双键17. 下列操作会使相应溶液pH增大的是( )A、 溶液中再加入 B、 溶液加热 C、氨水中加入少量 固体 D、醋酸溶液加热18. 对于下列实验,能正确描述其反应的离子方程式是( )A、同浓度同体积 溶液与 溶液混合: B、同浓度同体积 溶液与 溶液混合: C、向 溶液中滴加少量 : D、用 溶液吸收少量 :19. 对金属腐蚀及防护的表述正确的是( )A、金属腐蚀的本质:金属失电子发生还原反应 B、牺牲阳极的阴极保护法:被保护的金属应做负极 C、外加电流阴极保护法:被保护的金属应与电源正极相连 D、钢铁表面烤蓝生成一层致密的 ,能起到防腐蚀作用20. 用物质的量都是 的 和 配成1升混合溶液,已知其中 ,对该溶液的下列判断正确的是( )A、 B、 C、 D、二、综合题
-
21. 碳酸锂是生产锂离子电池的重要原料。(1)、碳酸锂制取锂的反应原理为:
① ;
② 。
锂原子的电子排布式为;CO2的结构式为;反应②中物质涉及的化学键类型有。
(2)、碳原子核外电子有种不同能量的电子,其中有两个电子的能量最高且能量相等,这两个电子所处的轨道分别是。(3)、氢化锂(LiH)是离子化合物,写出其阴离子的电子式 , 氢负离子(H-)与锂离子具有相同电子层结构,试比较两者微粒半径的大小,并用原子结构理论加以解释:。(4)、用 、氨水和液溴制备 。除生成 外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式: ,。(5)、磷酸亚铁锂电池总反应为: ,放电时,负极为(填写化学式)。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有 气体(标准状况)产生时,该电池消耗锂的质量为。22. 对烟道气中的 进行回收再利用具有较高的社会价值。(1)、大气中 含量过高会导致雨水中含有(填化学式)而危害植物和建筑物。工厂排放的 尾气用饱和 溶液吸收可得到重要化工原料 ,反应的化学方程式为。由 过饱和溶液结晶脱水可制得 。写出该过程的化学方程式。(2)、 可用作食品的抗氧化剂。在滴定某葡萄酒中 残留量时,取 葡萄酒样品,用 的碘标准液滴定至终点,消耗 碘液。补全该滴定反应的离子方程式: ,;该样品中 的残留量为 (以 计)。(3)、一定条件下,由SO2和CO反应生成S和CO2的能量变化如图所示,每生成16gS(s),该反应(选填“放出”或“吸收”)的热量为。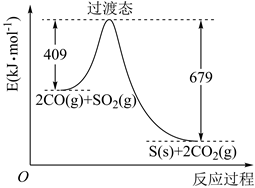 (4)、在绝对隔热恒容的密闭容器中,进行该反应的平衡常数表达式为 , 对此反应下列说法正确的是。
(4)、在绝对隔热恒容的密闭容器中,进行该反应的平衡常数表达式为 , 对此反应下列说法正确的是。a.若混合气体密度保持不变,则已达到平衡状态
b.从反应开始到平衡,容器内气体的压强保持不变
c.达平衡后若再充入一定量CO2 , 平衡常数保持不变
d.分离出少量S粉,正、逆反应速率均保持不变
23. G是一种新型香料的主要成分之一,合成路线如下:
已知:①RCH=CH2+CH2=CHR’ CH2=CH2+RCH=CHR’
②G的结构简式为:
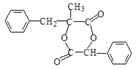 (1)、(CH3)2C=CH2分子中有个碳原子在同一平面内。(2)、D分子中含有的含氧官能团名称是 , F的结构简式为。(3)、A→B的化学方程式为 , 反应类型为。(4)、生成C的化学方程式为。(5)、同时满足下列条件的D的同分异构体有多种:①能发生银镜反应;②能水解;③苯环上只有一个取代基,请写出其中任意2种物质的结构式、。(6)、利用学过的知识以及题目中的相关信息,写出由丙烯制取CH2=CHCH=CH2的合成路线(无机试剂任选)。
(1)、(CH3)2C=CH2分子中有个碳原子在同一平面内。(2)、D分子中含有的含氧官能团名称是 , F的结构简式为。(3)、A→B的化学方程式为 , 反应类型为。(4)、生成C的化学方程式为。(5)、同时满足下列条件的D的同分异构体有多种:①能发生银镜反应;②能水解;③苯环上只有一个取代基,请写出其中任意2种物质的结构式、。(6)、利用学过的知识以及题目中的相关信息,写出由丙烯制取CH2=CHCH=CH2的合成路线(无机试剂任选)。(合成路线常用的表示方式为:
 )24. 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备 和 ,探究其氧化还原性质。
)24. 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备 和 ,探究其氧化还原性质。
回答下列问题:
(1)、盛放MnO2粉末的仪器名称是 , a中的试剂为 , b中采用的加热方式是 , c中化学反应的离子方程式是。(2)、反应结束后,取出b中试管,经冷却结晶, , , 干燥,得到 晶体。d的作用是 , 可选用试剂 (填编号)。a. b. c. d.
(3)、取少量 和 溶液分别置于1号和2号试管中,滴加中性 溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入 振荡,静置后 显色。可知该条件下 的氧化能力 (填“大于”或“小于”)。(4)、制备 时,温度过高会生成 。当 时,该反应中 。