初中化学计算题专题试卷
试卷更新日期:2021-05-24 类型:二轮复习
一、计算题
-
1. 实验室现有100mL溶质质量分数为98%的浓硫酸(密度为1.84/mL),欲稀释为9.8%的稀硫酸,需加水的质量是多少?2. 如表是 NaCl、NH4Cl 在不同温度时的溶解度。
温度/℃
0
20
40
60
80
溶解度/g
NaCl
35.7
36.0
36.6
37.3
38.4
NH4Cl
29.4
37.2
45.8
55.2
65.6
(1)、以上两种物质的溶解度受温度影响较大的是。(2)、40℃时,将 40.6g NaCl 加入到 100g 水中,充分搅拌使之溶解,所得溶液的质量为g。(3)、20℃时,NaCl 饱和溶液的溶质质量分数为(精确到小数点后 1 位)。3. 海南省生产水果椰子,椰汁和椰肉都可食用,椰子汁清如水,且相当清甜、清凉解渴.椰汁中含丰富的维生素C(化学式为C6H8O6),维生素C是一种抗氧化剂,能保护身体免于自由基的威胁.请回答下列问题:(1)、维生素C分子中碳、氢、氧原子个数比为。其中碳、氧元素质量比为。(2)、44g维生素C中含有g的氧元素。4. 某化学兴趣小组同学欲测定某铁粉与碳粉混合物中铁的质量分数,他们进行了如图所示的实验。请计算: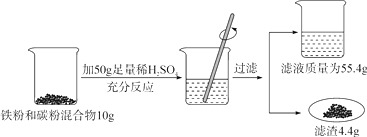 (1)、混合物中铁的质量。(2)、反应后烧杯中稀硫酸无剩余,请计算所用稀硫酸溶液中溶质的质量分数。(3)、欲用98%的浓硫酸配制该浓度的稀硫酸200g,需要水的质量是多少?5. 某碳酸钠样品中混有氯化钠,小红同学对该样品进行探究:称取20.4克该样品于烧杯中,然后缓慢加入稀盐酸至不再产生气泡为止,刚好用去稀盐酸156g,同时测得溶液pH=7;反应数据如图所示,试回答下列问题:
(1)、混合物中铁的质量。(2)、反应后烧杯中稀硫酸无剩余,请计算所用稀硫酸溶液中溶质的质量分数。(3)、欲用98%的浓硫酸配制该浓度的稀硫酸200g,需要水的质量是多少?5. 某碳酸钠样品中混有氯化钠,小红同学对该样品进行探究:称取20.4克该样品于烧杯中,然后缓慢加入稀盐酸至不再产生气泡为止,刚好用去稀盐酸156g,同时测得溶液pH=7;反应数据如图所示,试回答下列问题:
(1)、样品中碳酸钠的质量(请写出计算过程,下同)。
(2)、充分反应后溶液中溶质的质量分数。
6.为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:

①样品中铜的质量分数;
②反应所消耗的硫酸溶液质量;
③反应后所得溶液质量.
7. 用73g的稀盐酸和10%的氢氧化钠溶液进行反应实验时,反应过程中溶液的酸碱度变化如下图所示(反应的化学方程式 )。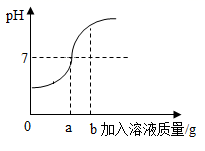 (1)、该实验是将(选填稀盐酸或氢氧化钠溶液)滴加到另一种溶液中。(2)、当加入溶液的质量为b时,此时溶液中的溶质是(填化学式)。(3)、当加入溶液的质量a为40g时,求所得溶液中溶质的质量分数。(结果精确到0.1%)8. 今年“五·一”假期,小丽随爸爸到乡下省亲,期间看到许多漂亮的大理石。于是她带了一些回来,想去学校实验室测定这些大理石中碳酸钙的含量。她称取了20克大理石样品置于烧杯中,然后将250g稀盐酸分成五等份,依次加入烧杯充分反应,记录有关实验数据如下表所示(大理石中其他成分均不溶于水,也不参与化学反应)。
(1)、该实验是将(选填稀盐酸或氢氧化钠溶液)滴加到另一种溶液中。(2)、当加入溶液的质量为b时,此时溶液中的溶质是(填化学式)。(3)、当加入溶液的质量a为40g时,求所得溶液中溶质的质量分数。(结果精确到0.1%)8. 今年“五·一”假期,小丽随爸爸到乡下省亲,期间看到许多漂亮的大理石。于是她带了一些回来,想去学校实验室测定这些大理石中碳酸钙的含量。她称取了20克大理石样品置于烧杯中,然后将250g稀盐酸分成五等份,依次加入烧杯充分反应,记录有关实验数据如下表所示(大理石中其他成分均不溶于水,也不参与化学反应)。加入次数
一
二
三
四
五
加入稀盐酸的质量/g
50
50
50
50
50
烧杯中剩余固体的质量/g
15
10
5
5
m
试求:
(1)、m的值应为;(2)、实验中大理石样品所含碳酸钙的质量分数?(3)、实验中所用稀盐酸的溶质质量分数?9. 化学兴趣小组的同学测定黄铜(铜锌合金)中铜的含量时,取黄铜样品40 ,放入烧杯中,向其中加入200 稀硫酸,恰好完全反应,生成气体的质量与反应时间的关系如图所示,请回答下列问题: (1)、完全反应时,产生氢气的质量是(2)、黄铜中铜的质量分数是(3)、试计算所用稀硫酸中溶质的质量分数。10. 某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图
(1)、完全反应时,产生氢气的质量是(2)、黄铜中铜的质量分数是(3)、试计算所用稀硫酸中溶质的质量分数。10. 某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图 (1)、纯碱恰好完全反应时,生成CO2的质量为g(2)、计算该样品中含杂质的质量分数是多少?(计算结果保留一位小数,下同)(3)、计算当盐酸与纯碱恰好完全反应时,所得溶液的溶质质量分数是多少?
(1)、纯碱恰好完全反应时,生成CO2的质量为g(2)、计算该样品中含杂质的质量分数是多少?(计算结果保留一位小数,下同)(3)、计算当盐酸与纯碱恰好完全反应时,所得溶液的溶质质量分数是多少?