上海市杨浦区2021年高考化学二模试卷
试卷更新日期:2021-05-24 类型:高考模拟
一、单选题
-
1. 科学家根据 与 的比例,为月球起源的假说提供证据。 与 具有相同的( )A、核外电子排布 B、质量数 C、中子数 D、质量2. 可降解塑料能从根本上解决白色污染。PLA(
 )是一种较成熟的可降解塑料。PLA可降解的原因是( ) A、分子量小 B、能溶解于水 C、能水解 D、能燃烧3. 利用物质性质差异进行分离是化学上常用的方法。纸上层析利用了物质的( )A、溶解性差异 B、熔点差异 C、沸点差异 D、密度差异4. 向苯、 、无水乙醇、己烯中分别滴加少量溴水,振荡、静置后,描述错误的是( )A、苯:上层红棕色,下层无色 B、无水乙醇:液体不分层 C、己烯:上层无色,下层无色 D、 :上层无色,下层紫色5. 下列物质来源的叙述,错误的是( )A、甲烷:可从天然气中得到 B、乙烯:可从石油分馏中得到 C、苯:可从煤焦油中得到 D、乙醇:可由粮食发酵得到6. 常温下,能鉴别浓 和稀 ,且与浓 强氧化性有关的是( )A、铝片 B、纸 C、铜片 D、焦炭7. 加热装有硫粉的试管,硫粉很快熔化为液体,继而有淡黄色气体产生。将光亮细铜丝伸气体中,铜丝发光发热且装而有黑色物质生成。由上述现象得不出的结论是( )A、硫的熔沸点较低 B、硫晶体属于分子晶体 C、铜丝能在硫蒸气中燃烧 D、黑色固体是8. 下图是能量示意图,由此判断热化学方程式正确的是( )
)是一种较成熟的可降解塑料。PLA可降解的原因是( ) A、分子量小 B、能溶解于水 C、能水解 D、能燃烧3. 利用物质性质差异进行分离是化学上常用的方法。纸上层析利用了物质的( )A、溶解性差异 B、熔点差异 C、沸点差异 D、密度差异4. 向苯、 、无水乙醇、己烯中分别滴加少量溴水,振荡、静置后,描述错误的是( )A、苯:上层红棕色,下层无色 B、无水乙醇:液体不分层 C、己烯:上层无色,下层无色 D、 :上层无色,下层紫色5. 下列物质来源的叙述,错误的是( )A、甲烷:可从天然气中得到 B、乙烯:可从石油分馏中得到 C、苯:可从煤焦油中得到 D、乙醇:可由粮食发酵得到6. 常温下,能鉴别浓 和稀 ,且与浓 强氧化性有关的是( )A、铝片 B、纸 C、铜片 D、焦炭7. 加热装有硫粉的试管,硫粉很快熔化为液体,继而有淡黄色气体产生。将光亮细铜丝伸气体中,铜丝发光发热且装而有黑色物质生成。由上述现象得不出的结论是( )A、硫的熔沸点较低 B、硫晶体属于分子晶体 C、铜丝能在硫蒸气中燃烧 D、黑色固体是8. 下图是能量示意图,由此判断热化学方程式正确的是( ) A、 B、 C、 D、9. 新制氯水的叙述错误的是( )A、含 ,呈黄绿色 B、逸出 ,有刺激性气味 C、光照时,放出氧气 D、含大量 ,有强氧化性10. 《自然科学》杂志上关于Li—空气电池如图所示。对该电池的分析正确的是( )
A、 B、 C、 D、9. 新制氯水的叙述错误的是( )A、含 ,呈黄绿色 B、逸出 ,有刺激性气味 C、光照时,放出氧气 D、含大量 ,有强氧化性10. 《自然科学》杂志上关于Li—空气电池如图所示。对该电池的分析正确的是( ) A、多孔碳材料是负极 B、Li发生氧化反应 C、电子由多孔碳材料沿导线流向Li D、 发生11. 利用下列装置制取 或验证其性质,不能达到实验目的的是( )
A、多孔碳材料是负极 B、Li发生氧化反应 C、电子由多孔碳材料沿导线流向Li D、 发生11. 利用下列装置制取 或验证其性质,不能达到实验目的的是( )



A.制取
B.验证氧化性
C.验证还原性
D.验证漂白性
A、A B、B C、C D、D12. 只由非金属元素组成的化合物,一定不具有的性质是( )A、固体导电 B、能溶于水 C、硬度大 D、熔点低13. 实验室制备乙烯和乙炔的叙述错误的是( )A、都不能用启普发生器 B、都需要温度计指示反应温度 C、都能用碱石灰除去产物中的酸性气体 D、都不能直接用溴水检验产物14. 乙酸丁酯的制备及提纯,不会涉及的装置或操作是( )A、 B、
B、 C、
C、 D、
D、 15. 某管道疏通剂主要成分是NaOH粉末和铝粉,可用于疏通管道中因毛发、残渣等造成的堵塞,使用时会产生大量气泡。对该疏通剂描述正确的是( )A、加冷水可提高效果 B、使用时应防明火以免发生爆炸 C、可敞口置于空气中保存 D、NaOH作氧化剂16. 图a~c分别为NaCl在不同状态下的导电实验(X、Y为石墨电极)微观示意图。下列分析错误的是( )
15. 某管道疏通剂主要成分是NaOH粉末和铝粉,可用于疏通管道中因毛发、残渣等造成的堵塞,使用时会产生大量气泡。对该疏通剂描述正确的是( )A、加冷水可提高效果 B、使用时应防明火以免发生爆炸 C、可敞口置于空气中保存 D、NaOH作氧化剂16. 图a~c分别为NaCl在不同状态下的导电实验(X、Y为石墨电极)微观示意图。下列分析错误的是( )


图a
图b
图c
A、图中 代表
B、a:NaCl固体,不导电
C、b:X与电源负极相连
D、c:Y上产生
17. Na2O2能与CO2发生反应,下列叙述错误的是( )A、有离子键、共价键的断裂与生成 B、O2既是氧化产物又是还原产物 C、反应物和生成物中都含离子晶体 D、标况下,转移2mol电子,气体体积减小22.4L18. X的相对分子质量为58,完全燃烧只生成 和 。下列判断正确的是( )A、若X只含C、H两种元素,则X有三种结构 B、若X能与新制 反应生成砖红色沉淀,则X是醛或甲酸酯 C、若0.1molX与足量银氨溶液反应得到43.2g的Ag,则X是 D、若X能使溴水褪色,又能与Na反应放出 ,则X是19. 一定条件下,6H2(g)+2CO2(g)⇌C2H5OH(g)+3H2O(g),CO2平衡转化率随温度变化图所示。对a、b、c三点对应情况的分析,合理的是( )
代表
B、a:NaCl固体,不导电
C、b:X与电源负极相连
D、c:Y上产生
17. Na2O2能与CO2发生反应,下列叙述错误的是( )A、有离子键、共价键的断裂与生成 B、O2既是氧化产物又是还原产物 C、反应物和生成物中都含离子晶体 D、标况下,转移2mol电子,气体体积减小22.4L18. X的相对分子质量为58,完全燃烧只生成 和 。下列判断正确的是( )A、若X只含C、H两种元素,则X有三种结构 B、若X能与新制 反应生成砖红色沉淀,则X是醛或甲酸酯 C、若0.1molX与足量银氨溶液反应得到43.2g的Ag,则X是 D、若X能使溴水褪色,又能与Na反应放出 ,则X是19. 一定条件下,6H2(g)+2CO2(g)⇌C2H5OH(g)+3H2O(g),CO2平衡转化率随温度变化图所示。对a、b、c三点对应情况的分析,合理的是( ) A、CO2物质的量分数:a>b B、C2H5OH物质的量分数:a<c C、平衡常数:Ka>Kc>Kb D、反应速率:va(CO2)<vb(CO2)20. 某溶液中可能含浓度均为0.5mol/L的 、 、 、 、 、 中的若干种。向该溶液中逐滴加入稀HCl至过量,无明显现象,得到溶液X,对X进行如下实验:
A、CO2物质的量分数:a>b B、C2H5OH物质的量分数:a<c C、平衡常数:Ka>Kc>Kb D、反应速率:va(CO2)<vb(CO2)20. 某溶液中可能含浓度均为0.5mol/L的 、 、 、 、 、 中的若干种。向该溶液中逐滴加入稀HCl至过量,无明显现象,得到溶液X,对X进行如下实验:
根据上述实验现象得出的结论,错误的是( )
A、可能含 、 、 B、沉淀N是 C、一定含 、 D、再检验一种离子即可确定原溶液成分二、综合题
-
21. 2020年9月科学家发现金星上有磷化氢( ),实验室制备 的常用方法有两种:
①
②
完成下列填空:
(1)、P核外能量最高的电子具有相同的___________(填写序号)。A、轨道 B、自旋方向 C、电子云形状 D、电子云伸展反应(2)、已知 与 的结构相似, 的空间结构是。 的分解温度比 (填“高”、“低”),判断的依据是。(3)、已知 为三元酸,其结构式为: 。
。
①次磷酸( 中的P的成键情况与 中的相同,则 的结构式是。
②利用反应②制备 时,即使KOH过量,仍只生成 ,说明 是元酸。
(4)、常温下, 在不同pH的溶液中,各种含磷微粒的质量分数如图所示。
①电离平衡常数与化学平衡常数意义相同,写出 第二步电离平衡常数表达式 。
(5)、图中可推断 溶液呈(填“酸”、“碱”、“中”)性,可能的原因是。 溶液中各含磷微粒以及 按浓度由大到小的顺序排列。22. Ba是第六周期ⅡA族的元素,常见的矿物重品石(主要成分是 含少量 、CaO、MgO等)中,以下是某工业制取 流程示意图:
完成下列填空:
(1)、重晶石和煤磨成粉能加快反应速率,原因是。(2)、焙烧时主要反应为: ,不同温度下反应达到平衡时,各成分的物质的量如图所示。
①依图判断生成BaS的反应是反应(填“放热”或“吸热”),焙烧温度至少应控制在℃上。某次焙烧在真空容器中进行,1.5h时,测得容器中气体的密度为26.88g/L,该反应的化学反应速率为。
②已知:90℃时BaS的溶解度为50g/100g水,浸取液中还存在三种碱 、 、 ,其中碱性最弱的是(填化学式)。浸取液中产生 的原因是。(用离子方程式表示)
(3)、向BaS溶液中加入 生成 , 过量会析出 晶体,利用平衡移动原理,解释析出品体的原因。(4)、工业上用 制备高纯 ,其流程图是:
①碳化时,先向 溶液中通入(写化学式),写出碳化时发生反应的化学方程式。
②写出检验母液中主要阳离子的实验方案。
23. 格式试剂即烃基卤化镁(R—MgX)是一类有机金属化合物,在有机合成中有着重要的作用。利用格式试剂设计了有机化合物J的合成路线:
已知:RX R-MgX
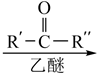
 (R、 、 代表烃基或氢)
(R、 、 代表烃基或氢)完成下列填空:
(1)、D中的官能团名称是:。(2)、写出反应类型:A→B是反应;B→D是反应。(3)、D能发生聚合反应,聚合产物为或。(4)、K是J的同分异构体,属于芳香族化合物,且分子中无甲基也无 ,任写出一种K的结构简式:。 (5)、写出H→I的化学方程式。(6)、利用格式试剂,写出以A、HCHO、乙醚为有机原料制备
,任写出一种K的结构简式:。 (5)、写出H→I的化学方程式。(6)、利用格式试剂,写出以A、HCHO、乙醚为有机原料制备 的合成路线。(其他无机试剂任选)。。 24. 打印机墨粉中的 含量是衡量墨粉质量优劣的重要指标之一、已知:墨粉中除了 晶体粉粒外,其余成分均不溶于水且不与酸反应。
的合成路线。(其他无机试剂任选)。。 24. 打印机墨粉中的 含量是衡量墨粉质量优劣的重要指标之一、已知:墨粉中除了 晶体粉粒外,其余成分均不溶于水且不与酸反应。为测定墨粉中 的含量,进行了如下实验:

完成下列填空:
(1)、检验第一份取少许,选用(填试剂名称),现象是。
(2)、测定 含量方法一
已知:
①试剂①是 ,加入足量 反应后,还需要充分加热,充分加热的目的是。
②试剂②是(填名称),其作用是。
(3)、测定 含量方法二
已知:
①试剂③是Zn粉,向第三份溶液中缓慢加入Zn粉末,当观察到较多气泡产生时,即停止加入Zn粉,写出该过程中发生的离子方程式 , 这样操作的原因是。
②用第三份实验数据计算墨粉中的 的含量。(只列计算式,不计算)
③试剂③不能用铁粉,可能的原因是。