上海市徐汇区2021年高考化学二模试卷
试卷更新日期:2021-05-24 类型:高考模拟
一、单选题
-
1. 下列说法错误的是( )A、不锈钢属于合金 B、14C的中子数为8 C、氯气常用于自来水杀菌消毒 D、铝热反应属于吸热反应2. 下列变化属于物理变化的是( )A、风化 B、升华 C、干馏 D、裂化3. 将铁钉投入热的浓硝酸中,一段时间后,下列说法错误的是( )A、铁钉表面形成致密的氧化膜 B、溶液可能呈棕黄色 C、铁钉会溶解 D、产生红棕色的气体4. 关于氯气变成液氯的过程,下列说法正确的是( )A、氯原子半径减小 B、分子间作用力变大 C、可以通过降低压强实现 D、液氯颜色比氯气浅5. BF3是非极性分子,下列有关说法错误的是( )A、B-F键是极性键 B、空间结构为三角锥型 C、键角均为120° D、所有原子共平面6. 不能说明Mg的金属性强于Al的是( )A、碱性:Mg(OH)2 > Al(OH)3 B、镁、铝与热水的反应 C、镁、铝与强碱溶液反应 D、镁、铝与盐酸的反应7. 下列转化在给定条件下能通过一步反应实现的是( )A、N2 NO2 B、Fe(OH)2 Fe(OH)3 C、S SO3 D、Al2O3 Al(OH)38. 电解法是制备物质的重要途径,下列物质不能通过电解盐溶液制备的是( )A、Na B、Cl2 C、H2 D、Cu9. 露置于空气不易因氧化而变质的是( )A、NaOH B、Na2SO3 C、KI D、FeCl210. 过氧化物在纺织业工业里有重要的作用,关于Na2O2的说法正确的是( )A、阴离子的电子数为10 B、阴阳离子个数比1:1 C、属于离子化合物 D、属于非电解质11. 需要使用温度计测定反应物温度的是( )A、制备乙酸乙酯 B、银镜反应 C、制备硝基苯 D、制备乙烯12. S2Cl2常用于制作橡胶的粘结剂,S2Cl2分子中各原子最外层均有8个电子,S2Cl2遇水会产生淡黄色沉淀和无色刺激性气味气体,下列说法正确的是( )A、S2Cl2可使品红溶液褪色 B、S2Cl2只做还原剂 C、S2Cl2结构式为Cl-S-Cl-S D、1mol S2Cl2与水完全反应,转移电子的个数为2NA13. 锥形瓶内壁用某溶液润洗后,放入混合均匀的新制铁粉和碳粉,塞紧瓶塞,同时测量锥形瓶内压强的变化,如图所示。下列说法错误的是( )
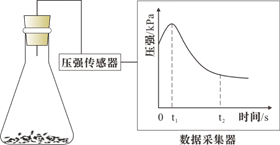 A、0~t1时,铁可能发生了析氢腐蚀 B、0~t1时,铁可能发生了吸氧腐蚀 C、t1~t2时,铁一定发生了吸氧腐蚀 D、用于润洗锥形瓶的溶液一定显酸性14. 下列有关化工生产的说法正确的是( )A、侯氏制碱法通过蒸氨实现氨气循环使用 B、工业合成氨使用铁触媒提高氢气的平衡转化率 C、海带提碘通入过量的氯气将I-完全氧化 D、工业制硫酸使用热交换器提高能量利用率15. 理论研究表明,在101kPa和298K下,HCN(g) HNC(g)异构化反应过程的能量变化如图所示。下列说法正确的是 ( )
A、0~t1时,铁可能发生了析氢腐蚀 B、0~t1时,铁可能发生了吸氧腐蚀 C、t1~t2时,铁一定发生了吸氧腐蚀 D、用于润洗锥形瓶的溶液一定显酸性14. 下列有关化工生产的说法正确的是( )A、侯氏制碱法通过蒸氨实现氨气循环使用 B、工业合成氨使用铁触媒提高氢气的平衡转化率 C、海带提碘通入过量的氯气将I-完全氧化 D、工业制硫酸使用热交换器提高能量利用率15. 理论研究表明,在101kPa和298K下,HCN(g) HNC(g)异构化反应过程的能量变化如图所示。下列说法正确的是 ( ) A、HCN和HNC中碳氮键完全相同 B、HCN和HNC互为同素异形体 C、1molHNC(g)的能量高于1molHCN(g) D、HCN(g) HNC(g)+59.3kJ16.
A、HCN和HNC中碳氮键完全相同 B、HCN和HNC互为同素异形体 C、1molHNC(g)的能量高于1molHCN(g) D、HCN(g) HNC(g)+59.3kJ16. 是一种通过加聚反应制备的工程塑料,具有类似金属的硬度和强度,下列有关的说法错误的是( ) A、单体为甲醛 B、不溶于水 C、属于高分子化合物 D、与环氧乙烷(
是一种通过加聚反应制备的工程塑料,具有类似金属的硬度和强度,下列有关的说法错误的是( ) A、单体为甲醛 B、不溶于水 C、属于高分子化合物 D、与环氧乙烷( )互为同系物
17. 下列物质分离(括号内的物质为杂质)方法正确的是( )A、溴苯(Br2)—— 分液 B、乙酸丁酯(正丁醇 )—— 过滤 C、乙酸乙酯(乙酸)—— 蒸馏 D、氯化铵(I2)—— 加热18. 测定a g小苏打(含少量氯化钠)中NaHCO3含量,下列说法错误的是( )
)互为同系物
17. 下列物质分离(括号内的物质为杂质)方法正确的是( )A、溴苯(Br2)—— 分液 B、乙酸丁酯(正丁醇 )—— 过滤 C、乙酸乙酯(乙酸)—— 蒸馏 D、氯化铵(I2)—— 加热18. 测定a g小苏打(含少量氯化钠)中NaHCO3含量,下列说法错误的是( )测定方法
选用试剂
测量数据
A
重量法
稀硝酸、硝酸银
m(AgCl)
B
气体法
稀硫酸
V(CO2)
C
滴定法
甲基橙、稀盐酸
V(HCl)
D
重量法
氢氧化钡
m(BaCO3)
A、A B、B C、C D、D19. 800℃时,可逆反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=1。800℃时,测得某一时刻密闭容器中各组分的浓度如下表,下列说法正确的是( )物质
CO
H2O
CO2
H2
浓度(mol/L)
0.002
0.003
0.0025
0.0025
A、此时,ʋ(正) > ʋ(逆) B、一段时间后,气体压强降低 C、一段时间后,H2O的体积分数增加 D、一段时间后,正反应速率减小20. 25℃时,向20 mL 0.10 mol·L-1一元酸HA中逐滴加入0.10 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示。下列说法正确的是( )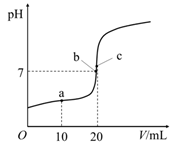 A、HA是强酸 B、a点,c(Na+) = c(A-) + c(HA) C、b点为滴定终点,c(Na+) > c(A-) D、c点,水的电离程度最大
A、HA是强酸 B、a点,c(Na+) = c(A-) + c(HA) C、b点为滴定终点,c(Na+) > c(A-) D、c点,水的电离程度最大二、综合题
-
21. 自然界中碳、氮、硫的循环是维持生态平衡的重要物质基础。
完成下列填空:
(1)、N原子核外未成对电子的电子云空间伸展方向有个;CS2的电子式。为了减少CO2的排放,利用CO2和H2在一定条件下可以合成CH3OH,反应的化学方程式为:CO2(g) + 3H2(g) CH3OH(g) + H2O(g),在5L密闭容器中充入1mol CO 2和3mol H2 , 测得一定时间内混合气体中CH3OH的体积分数φ(CH3OH)与温度的关系如下图所示。
 (2)、该反应的平衡常数K=;若温度为T时,反应10分钟,φ(CH3OH)=30%,则0~10分钟内,CH3OH的平均反应速率 ʋ =。(3)、该反应是反应(选填“吸热”或“放热”);其它条件相同时,CH3OH在a点的正反应速率 CH3OH在b点的正反应速率(选填“>”、“<”或“=”);解释温度低于T时,φ(CH3OH)逐渐增加的原因。(4)、化石燃料燃烧的烟气中含有影响环境的氮氧化物,因此要对烟气进行脱硝处理。液相氧化法采用碱性NaClO2溶液做吸收剂,反应如下:_ClO + _NO + _OH- → _NO + _Cl- + _H2O
(2)、该反应的平衡常数K=;若温度为T时,反应10分钟,φ(CH3OH)=30%,则0~10分钟内,CH3OH的平均反应速率 ʋ =。(3)、该反应是反应(选填“吸热”或“放热”);其它条件相同时,CH3OH在a点的正反应速率 CH3OH在b点的正反应速率(选填“>”、“<”或“=”);解释温度低于T时,φ(CH3OH)逐渐增加的原因。(4)、化石燃料燃烧的烟气中含有影响环境的氮氧化物,因此要对烟气进行脱硝处理。液相氧化法采用碱性NaClO2溶液做吸收剂,反应如下:_ClO + _NO + _OH- → _NO + _Cl- + _H2O配平上述方程式。
写出使用广范pH试纸测定溶液pH的方法。
22. 硫酸铜是一种重要盐。完成下列填空:
(1)、无水硫酸铜为色粉末,CuSO4·5H2O属于晶体,由饱和CuSO4溶液获取CuSO4·5H2O晶体的方法。(2)、向硫酸铜溶液中逐滴滴加NaHCO3溶液,产生含有Cu(OH)2的沉淀和无色气体,请用平衡知识解释原因。(3)、写出使用硫酸铜溶液制备新制氢氧化铜悬浊液的方法。(4)、实验室制备乙炔时,常用硫酸铜溶液除去杂质气体H2S,写出除杂时发生的离子方程式。0.80 g CuSO4·5H2O样品受热脱水过程中热重曲线如图所示。 (5)、计算确定200℃时固体物质的化学式。(6)、用法分离混合液中的铜离子和铁离子。23. H是一种治疗高血压的药物,合成该药物的一种路线如下。
(5)、计算确定200℃时固体物质的化学式。(6)、用法分离混合液中的铜离子和铁离子。23. H是一种治疗高血压的药物,合成该药物的一种路线如下。
已知:a.化合物G中除苯环还有其它环
b.


c.ROR1 RX RCOOH
完成下列填空:
(1)、写出①的反应类型。(2)、C中含氧官能团名称。(3)、写出E的结构简式为。(4)、H发生消去反应所需的试剂和条件。(5)、写出F → G的化学方程式。(6)、写出满足下列条件,D同分异构体的结构简式。①能发生银镜反应;②苯环上的一卤代物只有一种
(7)、设计从芳香烃A到B的合成路线(其它无机试剂任选) 。 (合成路线常用的表达方式为:A B 目标产物)24. 苯乙酮( )广泛用于皂用香精中,可由苯和乙酸酐(
)广泛用于皂用香精中,可由苯和乙酸酐(  )制备。
)制备。 已知:
名称
相对分子质量
熔点/℃
沸点/℃
密度/(g·mL-1 )
溶解性
苯
78
5.5
80.1
0.88
不溶于水,易溶于有机溶剂
苯乙酮
120
19.6
203
1.03
微溶于水,易溶于有机溶剂
乙酸酐
102
-73
139
1.08
有吸湿性,易溶于有机溶剂
乙酸
60
16.6
118
1.05
易溶于水,易溶于有机溶剂
步骤I 向三颈烧瓶中加入39 g苯和44.5 g无水氯化铝,在搅拌下滴加25.5 g乙酸酐,在70~80℃下加热45min,发生反应如下:
 +
+  CH3COOH+
CH3COOH+ 
步骤II 冷却后将反应物倒入100g冰水中,有白色胶状沉淀生成,采用合适的方法处理,水层用苯萃取,合并苯层溶液,再依次用30 mL 5% NaOH溶液和30 mL水洗涤,分离出的苯层用无水硫酸镁干燥。
步骤III 常压蒸馏回收苯,再收集产品苯乙酮。
请回答下列问题:
(1)、AlCl3在反应中作用;步骤I中的加热方式为。(2)、根据上述实验药品的用量,三颈烧瓶的最适宜规格为___________ (填标号)。A、100 mL B、250 mL C、500 mL D、1000 mL(3)、图示实验装置虚线框内缺少一种仪器,该仪器的作用为。 (4)、步骤II中生成的白色胶状沉淀的化学式为。(5)、步骤II中用NaOH溶液洗涤的目的是。(6)、步骤III中将苯乙酮中的苯分离除去所需的温度。(7)、实验中收集到24.0 mL苯乙酮,则苯乙酮的产率为。
(4)、步骤II中生成的白色胶状沉淀的化学式为。(5)、步骤II中用NaOH溶液洗涤的目的是。(6)、步骤III中将苯乙酮中的苯分离除去所需的温度。(7)、实验中收集到24.0 mL苯乙酮,则苯乙酮的产率为。