上海市浦东新区2021年高考化学二模试卷
试卷更新日期:2021-05-24 类型:高考模拟
一、单选题
-
1. “嫦娥五号”飞船采集回的月壤在空气中会变色,可能是因为空气中含有( )A、 B、 C、 D、Ar2. “中国”一词最早见于西周的青铜器(主要成分为铜、锡、铅等)上。下列有关青铜的说法中错误的是( )A、冶铜技术早于炼铁 B、具有导电性 C、熔点高于纯铜 D、硬度大于纯铅3. 不能使溴水褪色的气体是( )A、 B、 C、 D、4. 中国科学家率先合成出可降解塑料:聚二氧化碳,对其判断合理的是( )A、含碳量与 不同 B、属于纯净物 C、会产生白色污染 D、结构可表示为
 5. 溶液足量时,下列各组物质发生反应,金属一定有剩余的是( )A、铝与氯化铁溶液 B、锌与浓盐酸 C、铜与浓硫酸(加热) D、铝与浓硝酸(常温)6. 下列溶液敞口放置后,pH一定能增大的是( )A、浓醋酸 B、酸雨样品 C、漂粉精溶液 D、石灰水7. 关于氯、溴、碘的叙述错误的是( )A、易形成 价离子 B、都只能从海洋中提取 C、单质熔沸点依次上升 D、气态氢化物稳定性依次减弱8. 化学家从一个三角形分子( )入手,“撕裂”出世界上第一个完全由碳原子构成的环状分子 ,该分子是单键和叁键交替的结构,其过程如图所示:
5. 溶液足量时,下列各组物质发生反应,金属一定有剩余的是( )A、铝与氯化铁溶液 B、锌与浓盐酸 C、铜与浓硫酸(加热) D、铝与浓硝酸(常温)6. 下列溶液敞口放置后,pH一定能增大的是( )A、浓醋酸 B、酸雨样品 C、漂粉精溶液 D、石灰水7. 关于氯、溴、碘的叙述错误的是( )A、易形成 价离子 B、都只能从海洋中提取 C、单质熔沸点依次上升 D、气态氢化物稳定性依次减弱8. 化学家从一个三角形分子( )入手,“撕裂”出世界上第一个完全由碳原子构成的环状分子 ,该分子是单键和叁键交替的结构,其过程如图所示:
下列说法正确的是( )
A、 属于不饱和烃 B、“撕裂”过程发生了分解反应 C、 和 互为同系物 D、“撕裂”过程主要克服了分子间作用力9. 水可以发生如下变化:冰 液态水(4℃) 水蒸气(100℃) 氢气+氧气
下列说法正确的是( )
A、过程①中物质体积膨胀 B、过程②中分子间距缩小 C、过程③中涉及化学键的断裂和形成 D、过程②与过程④互为可逆反应10. 关于化工生产的叙述正确的是( )A、合成氨工业中, 、 循环使用使得原料的总转化率较高 B、硫酸工业中,大块黄铁矿石不能煅烧,因此必须将其粉碎 C、石油分馏得到乙烯 D、氯碱工业生产纯碱11. “天问一号”于2021年2月被火星捕获。火星大气中含有羰基硫(COS)分子,其结构与 相似,关于羰基硫的说法正确的是( )A、比例模型: B、结构式:
C、共用电子对都偏向碳
D、是含有极性键的非极性分子
12. 关于有机物X(结构如图)的说法正确的是( )
B、结构式:
C、共用电子对都偏向碳
D、是含有极性键的非极性分子
12. 关于有机物X(结构如图)的说法正确的是( ) A、所有碳原子均在同一平面内 B、常温下呈气态 C、与苯互为同分异构体 D、一氯取代物有2种13. 土壤中游离 越多,绣球花的颜色越蓝。若想种出蓝色绣球花,可向土壤中加入硫酸铝。为保证调色效果,不宜同时施用( )A、硫酸亚铁 B、硝酸钾 C、碳酸钾 D、氯化铵14. 实验室制取乙酸乙酯的过程中,未涉及的操作是( )A、
A、所有碳原子均在同一平面内 B、常温下呈气态 C、与苯互为同分异构体 D、一氯取代物有2种13. 土壤中游离 越多,绣球花的颜色越蓝。若想种出蓝色绣球花,可向土壤中加入硫酸铝。为保证调色效果,不宜同时施用( )A、硫酸亚铁 B、硝酸钾 C、碳酸钾 D、氯化铵14. 实验室制取乙酸乙酯的过程中,未涉及的操作是( )A、 B、
B、 C、
C、 D、
D、 15. 已知: 。不同情况下反应过程的能量变化如图。下列结论正确的是( )
15. 已知: 。不同情况下反应过程的能量变化如图。下列结论正确的是( ) A、1mol (g)和3mol (g)混合后反应,放出Q kJ热量 B、催化剂可以改变反应途径,缩短达到平衡的时间 C、当生成的水为液态时,Q值减小 D、催化剂不同,反应的热效应不同16. 选取 和 的醋酸溶液分别与生铁反应,进行腐蚀实验,测量密闭容器内压强变化情况如图。下列结论错误的是( )
A、1mol (g)和3mol (g)混合后反应,放出Q kJ热量 B、催化剂可以改变反应途径,缩短达到平衡的时间 C、当生成的水为液态时,Q值减小 D、催化剂不同,反应的热效应不同16. 选取 和 的醋酸溶液分别与生铁反应,进行腐蚀实验,测量密闭容器内压强变化情况如图。下列结论错误的是( ) A、 的醋酸溶液中一定存在吸氧腐蚀 B、酸度不同,腐蚀的主要类型可能不同 C、两组溶液的pH一定逐渐变大 D、若改用盐酸进行实验,腐蚀速率一定变大17. 按如图所示装置进行实验,逐滴加入液体x后,下列实验目的能够实现的是( )
A、 的醋酸溶液中一定存在吸氧腐蚀 B、酸度不同,腐蚀的主要类型可能不同 C、两组溶液的pH一定逐渐变大 D、若改用盐酸进行实验,腐蚀速率一定变大17. 按如图所示装置进行实验,逐滴加入液体x后,下列实验目的能够实现的是( )
选项
x
y
z
实验目的
A
浓氨水
生石灰
溶液
验证 能溶于碱
B
稀醋酸
小苏打
澄清石灰水
验证醋酸的酸性强于碳酸
C
水
过氧化钠
溶液
验证 具有还原性
D
70%硫酸
亚硫酸钠
紫色石蕊试液
验证二氧化硫的漂白性
A、A B、B C、C D、D18. 在铁粉与水蒸气反应后的残留固体X中,加入足量的稀硫酸,充分反应后得到溶液Y。下列说法正确的是( )A、若X中含有铁,则反应时一定有气泡 B、若向Y中滴入KSCN溶液显红色,则X中无铁 C、Y一定能使高锰酸钾溶液褪色 D、Y中滴入NaOH溶液,一定有沉淀产生19. 某新型氨氮去除技术中的含氮物质转化关系如图所示。下列说法正确的是( ) A、过程Ⅰ还需要加入氧化剂 B、过程Ⅱ反应后酸性减弱 C、过程Ⅲ中,参与反应的 与 的物质的量之比为4∶3 D、过程Ⅰ、Ⅱ、Ⅲ的总反应为:20. 某温度下,向浓氯水(由0.12mol氯气溶于水配制而成)中,以恒定速率滴入NaOH溶液,溶液中 和 的物质的量与时间t的关系曲线如图:
A、过程Ⅰ还需要加入氧化剂 B、过程Ⅱ反应后酸性减弱 C、过程Ⅲ中,参与反应的 与 的物质的量之比为4∶3 D、过程Ⅰ、Ⅱ、Ⅲ的总反应为:20. 某温度下,向浓氯水(由0.12mol氯气溶于水配制而成)中,以恒定速率滴入NaOH溶液,溶液中 和 的物质的量与时间t的关系曲线如图:
下列说法正确的是( )
A、 时,溶液中的含氯微粒为: 、 B、 时,发生的离子反应是: C、 时,溶液中存在如下关系: D、 时,溶液中含NaCl 0.20mol二、综合题
-
21. 硅铝合金广泛应用于航空、交通、建筑、汽车等行业。
完成下列填空:
(1)、硅原子的结构示意图为;比较硅铝的原子半径:r(Si)r(Al)(选填:“>”、“<”或“=”)。硅铝合金中的铝与氢氧化钠溶液反应的化学方程式为。(2)、氟化铝和氯化铝的熔点分别为1040 和194 ,它们熔点差异大的原因可能是。(3)、门捷列夫准确预测了铝、硅下一周期的同主族元素(当时并未被发现)的性质,并将他们分别命名为“类铝”和“类硅”。你据此推断类铝的最外层电子排布式为 , 推断的依据是。(4)、制备硅铝合金时,在高温真空炉中发生如下反应:; ;
上述反应的最终还原产物为;当有1mol C参加反应时,转移的电子数目为。
22. 有机物H是合成抗肿瘤药物的重要中间体,其合成路线如下:
完成下列填空:
(1)、E中含有的官能团名称为。A的分子式为。④的反应类型为。(2)、反应②的化学方程式为。(3)、合成过程中使用TBSCl试剂的目的是。(4)、G的同分异构体有多种,写出一种满足下列条件的结构简式。①能使石蕊试液变色;②能发生银镜反应;③分子中含有两个甲基。
(5)、设计由乙酸和1,3-丁二烯为原料合成G( )的路线。 (合成路线常用的表示方式为:甲 乙…… 目标产物)23. “绿色化学”是化工生产中的重要理念。下图为利用尿素工厂废气以及磷肥工厂废渣(液)联合生产硫酸铵的工艺流程。
完成下列填空:
(1)、沉淀池中发生反应的化学方程式为。已知硫酸铵溶解度变化趋势与氯化钠相似,则从沉淀池中获得产品的操作包含、、洗涤、烘干等。(2)、流程中体现“绿色化学”理念的设计有、等。(3)、为在实验室模拟沉淀池中的反应,设计了如图所示的装置,导管a下端连接粗管的目的是;导管b下端使用多孔球泡的目的是。
可用甲醛法测定所得 样品中氮的质量分数。其反应原理可以表示为:
[已知: 不与NaOH反应]
实验过程:称取样品1.500g,溶解配制成250mL溶液,取25.00mL样品溶液于锥形瓶中,加入过量的甲醛溶液,摇匀、静置5min后,加入1~2滴甲基橙试液,用NaOH标准溶液滴定至终点。
(4)、终点的判断依据是。(5)、已知 ,消耗氢氧化钠溶液20.00mL,则所得硫酸铵样品中氮的质量分数为。(保留4位小数),实验测得硫酸铵样品中氮的质量分数略高,原因可能是。a.甲醛被氧化 b.没有进行平行实验
c.氢氧化钠溶液久置变质 d.锥形瓶没有用待测液润洗
24. 利用 可消除CO污染或定量测定CO,反应为:完成下列填空:
(1)、该反应的平衡常数表达式 。在2L恒容密闭容器中反应25min后,固体质量减少了6.4g,则0~25min 的平均反应速率为。(2)、取一定量的 和CO于某密闭容器中,分别在80 和100 下进行实验,测得 如下:时间/min
温度
0
10
20
30
40
50
80
0.50
0.37
0.26
0.18
0.12
0.12
100
0.50
0.35
0.24
0.17
x
0.15
上表中 , 理由是。根据上表数据可以得出的结论是。
(3)、如图所示,300 时 的百分含量随着压强的增大而减小,请解释其原因。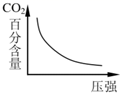 (4)、 可用高浓度NaOH溶液吸收。
(4)、 可用高浓度NaOH溶液吸收。①若4.48L (标准状况)和0.35mol NaOH溶液完全反应,生成的碳酸钠和碳酸氢钠的物质的量之比为。
②继续通入二氧化碳至溶液中碳酸钠和碳酸氢钠(碳酸氢钠溶液呈碱性)的物质的量之比1∶1,则溶液中各离子浓度大小顺序为。
③若使碳酸氢钠溶液中 的比值变小,可加入的物质是。
a.通入HCl b.NaOH固体 c.通入 d. 固体