上海市闵行区2021年高考化学二模试卷
试卷更新日期:2021-05-24 类型:高考模拟
一、单选题
-
1. 不能用来作为新冠病毒的消毒剂是( )A、84消毒液 B、漂粉精 C、75%酒精 D、明矾2. 第75号元素铼是广泛用于航空发动机涡轮叶片的稀土元素。从信息中不能获取的是( )A、质量数 B、周期表中位置 C、质子数 D、核外电子排布3. 因被氧化而使溴水褪色的是( )A、苯 B、二氧化硫 C、乙烯 D、氢氧化钠溶液4. 铝锂合金是应用于航空航天领域的新型材料,下列性质与其应用无关的是( )A、导电性好 B、密度小 C、硬度大 D、熔点比铝低5. 有关氮肥的说法正确的是( )A、氮肥都含铵根离子 B、NH4NO3是复合氮肥 C、自然固氮可产生尿素 D、自然界氮循环能产生铵盐6. 关于丙烯的描述正确的是( )A、电子式为:
 B、最多有7个原子共面
C、与1,3-丁二烯是同系物
D、不能发生取代反应
7. 常温下三氧化硫以液态(SO3)3聚合存在,气化时以SO3存在。已知SO3分子结构是平面三角型。有关说法正确的是( )A、由液态变气态是物理变化 B、SO3属于弱电解质 C、SO3含有极性键 D、SO3是极性分子8. 在硫酸铜晶体(CuSO4·nH2O)结晶水含量测定的操作中,导致n值偏小的是( )A、坩埚未干燥 B、在空气中冷却 C、加热过程中晶体爆溅 D、加热时间过长部分变黑9. 下列实验中,所加固体可以完全溶解的是( )A、常温下小块铝片投入足量浓硫酸中 B、少量碘片投入足量溴化钠中 C、小块硫磺投入足量二硫化碳中 D、小块铜片投入热乙醇溶液中10. 能用键能解释,且结论正确的是( )A、熔点:金刚石>晶体硅 B、分子稳定性:H2O > HF C、溶解度:SO2 > CO2 D、状态:常温时Cl2是气态11. 某溶液可能含有等物质的量的Ba2+、Na+、 、H+、Cl-、I-、 、 中的几种,向该溶液中滴加少量新制氯水,所得溶液为无色。判断错误的是( )A、肯定不含 B、肯定不含H+ C、肯定含有 D、肯定不含Cl-12. 有X、Y、Z三种元素,它们的原子序数都小于20,对应离子X+、Y2-、Z-具有相同的电子层结构。有关描述中正确的是( )A、原子序数:Z>X>Y B、还原性:Z->Y2- C、Z元素最高价为+7 D、X与Y可形成X2Y2化合物13. 在给定条件下,下列物质间转化能实现的是( )A、S SO2 H2SO3 B、NH3 NO2 HNO3 C、Fe2O3 Fe FeCl3 D、Al NaAlO2 Al(OH)314. 港珠澳大桥桥体的钢构件采用了多种防腐方法。有关其分析正确的是( )A、越靠近海底的钢构件,腐蚀越严重 B、钢构件上镶嵌铝块,属牺牲阳极阴极保护法 C、钢构件若腐蚀,正极反应式为:Fe-2e-=Fe2+ D、钢构件表面喷涂环氧树脂涂层,防止形成电解池15. I2(s)+ H2(g)⇌2HI(g)能量变化如图所示,有关叙述错误的是( )
B、最多有7个原子共面
C、与1,3-丁二烯是同系物
D、不能发生取代反应
7. 常温下三氧化硫以液态(SO3)3聚合存在,气化时以SO3存在。已知SO3分子结构是平面三角型。有关说法正确的是( )A、由液态变气态是物理变化 B、SO3属于弱电解质 C、SO3含有极性键 D、SO3是极性分子8. 在硫酸铜晶体(CuSO4·nH2O)结晶水含量测定的操作中,导致n值偏小的是( )A、坩埚未干燥 B、在空气中冷却 C、加热过程中晶体爆溅 D、加热时间过长部分变黑9. 下列实验中,所加固体可以完全溶解的是( )A、常温下小块铝片投入足量浓硫酸中 B、少量碘片投入足量溴化钠中 C、小块硫磺投入足量二硫化碳中 D、小块铜片投入热乙醇溶液中10. 能用键能解释,且结论正确的是( )A、熔点:金刚石>晶体硅 B、分子稳定性:H2O > HF C、溶解度:SO2 > CO2 D、状态:常温时Cl2是气态11. 某溶液可能含有等物质的量的Ba2+、Na+、 、H+、Cl-、I-、 、 中的几种,向该溶液中滴加少量新制氯水,所得溶液为无色。判断错误的是( )A、肯定不含 B、肯定不含H+ C、肯定含有 D、肯定不含Cl-12. 有X、Y、Z三种元素,它们的原子序数都小于20,对应离子X+、Y2-、Z-具有相同的电子层结构。有关描述中正确的是( )A、原子序数:Z>X>Y B、还原性:Z->Y2- C、Z元素最高价为+7 D、X与Y可形成X2Y2化合物13. 在给定条件下,下列物质间转化能实现的是( )A、S SO2 H2SO3 B、NH3 NO2 HNO3 C、Fe2O3 Fe FeCl3 D、Al NaAlO2 Al(OH)314. 港珠澳大桥桥体的钢构件采用了多种防腐方法。有关其分析正确的是( )A、越靠近海底的钢构件,腐蚀越严重 B、钢构件上镶嵌铝块,属牺牲阳极阴极保护法 C、钢构件若腐蚀,正极反应式为:Fe-2e-=Fe2+ D、钢构件表面喷涂环氧树脂涂层,防止形成电解池15. I2(s)+ H2(g)⇌2HI(g)能量变化如图所示,有关叙述错误的是( ) A、正反应为吸热反应 B、该反应的反应热为E2-E1 C、加入催化剂,E1、E2都不变 D、若I2为气态,则该反应热大于E2-E116. 盆栽鲜花施用S-诱抗素剂(结构如图)以保持鲜花盛开。说法正确的是( )
A、正反应为吸热反应 B、该反应的反应热为E2-E1 C、加入催化剂,E1、E2都不变 D、若I2为气态,则该反应热大于E2-E116. 盆栽鲜花施用S-诱抗素剂(结构如图)以保持鲜花盛开。说法正确的是( ) A、分子式为C14H16O4 B、分子中的羟基能被催化氧化 C、能跟溴水发生1,4-加成反应 D、1mol该物质与足量钠反应产生0.5mol氢气17. 下列工业生产采取的措施能达到相应目的的是( )
A、分子式为C14H16O4 B、分子中的羟基能被催化氧化 C、能跟溴水发生1,4-加成反应 D、1mol该物质与足量钠反应产生0.5mol氢气17. 下列工业生产采取的措施能达到相应目的的是( )选项
化学工业
措施
目的
A
合成氨
500℃左右
防止催化剂中毒
B
石油化工
裂化
提高轻质油的产量
C
工业制硫酸
V2O5催化
提高SO2的转化率
D
侯氏制碱
先通CO2
有利于CO2充分吸收
A、A B、B C、C D、D18. 在恒容密闭容器中,发生反应M(g)⇌2N(g) △H=Q(Q>0),下列说法正确的是( )A、反应速率之比始终是v逆=2v正 B、改变条件使平衡正向移动时,转化率均增大 C、混合气体的平均分子质量保持不变可判断该反应达到平衡 D、加压,平衡逆向移动,正反应速率减小,逆反应速率加快19. 室温时用下列实验装置进行相应实验,能达到目的的是( ) A、制取乙酸丁酯 B、验证乙炔的还原性 C、验证浓硫酸具有强氧化性 D、分离乙酸乙酯与碳酸钠溶液20. 常温时,同浓度的①V1mLCH3COOH溶液 ②V2mLNaOH溶液 ③V3mLCH3COONa溶液,下列结论中正确的是( )A、①与②混合若pH>7,则V2>V1 B、当V2=V3时,溶液中离子种数③>② C、将①稀释10倍,溶液中c(H+)∙c(OH−)增大 D、③溶液中:c(H+)−c(OH−)=c(CH3COO−)−c(CH3COOH)
A、制取乙酸丁酯 B、验证乙炔的还原性 C、验证浓硫酸具有强氧化性 D、分离乙酸乙酯与碳酸钠溶液20. 常温时,同浓度的①V1mLCH3COOH溶液 ②V2mLNaOH溶液 ③V3mLCH3COONa溶液,下列结论中正确的是( )A、①与②混合若pH>7,则V2>V1 B、当V2=V3时,溶液中离子种数③>② C、将①稀释10倍,溶液中c(H+)∙c(OH−)增大 D、③溶液中:c(H+)−c(OH−)=c(CH3COO−)−c(CH3COOH)二、填空题
-
21. NaNO2 是一种白色易溶于水的固体,俗称工业盐,在漂白、电镀等方面应用广泛,完成下列填空:(1)、钠元素核外有种能量不同的电子;氮元素原子最外层电子的轨道排布式为。(2)、NaNO2晶体类型是;组成NaNO2的三种元素,其对应的简单离子半径由小到大的顺序为。22. 尿素和氨气对于提高农作物产量和品质有重要作用,合成尿素的反应为:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(l),完成下列填空:(1)、该反应的化学平衡常数表达式为。(2)、在恒定温度下,将NH3和CO2按物质的量之比2:1充入固定体积为10L的密闭容器,经20min达到平衡,此时固体质量增加120g。用CO2表示20min内的化学反应速率为。(3)、合成尿素时不同温度下CO2转化率变化曲线如图:

该反应正方向为热反应(选填“吸”或“放”)。a、b、c三点对应温度下的平衡常数大小关系如何:(用Ka、Kb、Kc表示),理由为。
23. 在某温度时,将1.0mol・L-1氨水滴入10 mL1.0mol・L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示: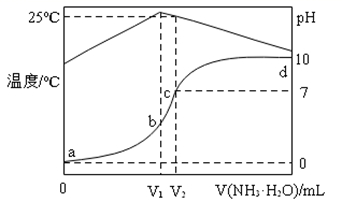 (1)、a、b、c、d对应的溶液中水的电离程度由大到小的是。(2)、氨水体积滴至时(填“V1”或“V2”),氨水与盐酸恰好完全反应,简述判断依据;此时溶液中离子浓度由大到小的顺序是。
(1)、a、b、c、d对应的溶液中水的电离程度由大到小的是。(2)、氨水体积滴至时(填“V1”或“V2”),氨水与盐酸恰好完全反应,简述判断依据;此时溶液中离子浓度由大到小的顺序是。三、综合题
-
24. 工业上可用NaNO2从含I-的卤水中提取单质碘。流程如下:
 (1)、酸性条件下,含I-的卤水发生如下反应: +I-+_→NO ↑+I2 +_,补充完整方程式并配平:;当有0.75mol I-参与反应时,在标准状况下产生气体的体积是L。(2)、上述反应为什么不选用常见的氧化剂氯气,而选择价格并不便宜的NaNO2 , 可能原因是。(3)、从第②步反应后的溶液中提纯I2涉及到的方法可以是(选填编号)。
(1)、酸性条件下,含I-的卤水发生如下反应: +I-+_→NO ↑+I2 +_,补充完整方程式并配平:;当有0.75mol I-参与反应时,在标准状况下产生气体的体积是L。(2)、上述反应为什么不选用常见的氧化剂氯气,而选择价格并不便宜的NaNO2 , 可能原因是。(3)、从第②步反应后的溶液中提纯I2涉及到的方法可以是(选填编号)。a.萃取 b.升华 c.纸层析 d.过滤
(4)、在富集碘元素过程中,还使用了NaHSO3溶液。该物质既能水解又能电离,设计实验验证其水解程度和电离程度的相对大小。25. 物质G是升高白细胞的常见药物,合成 G的路线如下: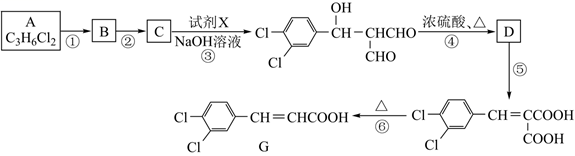
已知:R-CHO+R′-CH2-CHO
 (-R、-R′代表烃基)
(-R、-R′代表烃基)完成下列填空:
(1)、①的反应条件是;②的反应方程式。(2)、试剂X的结构简式为;④的反应类型是。(3)、⑤的反应试剂是;步骤④、⑤不能颠倒的原因是。(4)、C有多种同分异构体,写出满足下列条件的一种同分异构体的结构简式。①只有两种不同官能团 ②有3种不同化学环境的氢原子
(5)、设计以 为原料合成
为原料合成  的路线(无机试剂任选)。(合成路线流程图示例为:X Y…… 目标产物) 26. 莫尔盐[(NH4)2Fe(SO4)2・6H2O,392g/mol]是一种重要的还原剂,可通过以下流程制取:
的路线(无机试剂任选)。(合成路线流程图示例为:X Y…… 目标产物) 26. 莫尔盐[(NH4)2Fe(SO4)2・6H2O,392g/mol]是一种重要的还原剂,可通过以下流程制取:Fe2(SO4)3溶液 FeSO4溶液 (NH4)2Fe(SO4)2溶液 莫尔盐
已知:硫酸铵、水合硫酸亚铁、硫酸亚铁铵在水中的溶解度
10
20
30
40
(NH4)2SO4
73.0
75.4
78.0
81.0
FeSO4∙7H2O
40.0
48.0
60.0
73.3
(NH4)2SO4∙ ∙FeSO4∙6H2O
18.1
21.2
24.5
27.9
完成下列填空:
(1)、配制Fe2(SO4)3溶液需加入少量稀硫酸,目的是。(2)、(NH4)2SO4溶液和FeSO4溶液混合会生成(NH4)2Fe(SO4)2的原因是。(3)、隔绝空气下莫尔盐受强热分解会产生多种气体。利用如下装置验证气体中存在H2O、SO2和SO3。验证气体的装置次序为;c装置中足量盐酸的作用是。 (4)、测定莫尔盐样品的纯度:称取莫尔盐样品20.000g,用蒸馏水配成250mL溶液,取25.00mL溶液加入稀硫酸,用0.1000mol・L-1的KMnO4 溶液滴定三次,达到滴定终点时平均消耗10.00mLKMnO4溶液。
(4)、测定莫尔盐样品的纯度:称取莫尔盐样品20.000g,用蒸馏水配成250mL溶液,取25.00mL溶液加入稀硫酸,用0.1000mol・L-1的KMnO4 溶液滴定三次,达到滴定终点时平均消耗10.00mLKMnO4溶液。①蒸馏水要预先加热煮沸的原因是;配成250mL溶液的定量仪器为。
②若滴定前不用标准液润洗滴定管,将会导致最终结果(选填“偏大”、“偏小”或“不变”);
③已知滴定反应中n(Fe2+):n( )为5:1,该样品的纯度为。