上海市黄浦区2021年高考化学二模试卷
试卷更新日期:2021-05-24 类型:高考模拟
一、单选题
-
1. 化学与生产、生活密切相关。下列说法正确的是( )A、用盐酸清洗长时间存放漂白粉的试剂瓶 B、石油经裂化获得乙烯等化工原料 C、用明矾对饮用水消毒 D、联合制碱法制烧碱
-
2. 中科院研制出一种多功能催化剂,首次实现将 转化为汽油,过程示意图如下。下列说法错误的是( )
 A、该技术能助力“碳中和”(二氧化碳“零排放”)的战略愿景 B、b的一氯代物有4种 C、反应①的产物中含有水,反应②只有碳氢键的形成 D、汽油主要是 的烃类混合物
A、该技术能助力“碳中和”(二氧化碳“零排放”)的战略愿景 B、b的一氯代物有4种 C、反应①的产物中含有水,反应②只有碳氢键的形成 D、汽油主要是 的烃类混合物 -
3. 下列化学用语只能用来表示一种微粒的是( )A、 B、 C、
 D、
D、
-
4. 下列化学式所表示的物质中,属于含共价键的离子化合物是( )A、 B、 C、 D、
-
5. 将下列气体通入溶有足量 的 溶液中,没有沉淀产生的是( )A、 B、HCl C、 D、
-
6. 关于海水提溴和海带提碘的说法错误的是( )A、都经过浓缩、氧化、提取三个步骤 B、氧化步骤都可以通入氯气来实现 C、提取时利用了溴和碘的物理性质 D、实验室模拟时都用到了蒸发皿
-
7. 用如图装置完成电解实验,对实验现象的解释或推测合理的是( )
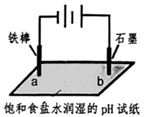 A、a处的试纸变红 B、b电极是正极 C、a处发生的电极反应: D、b处发生的电极反应:
A、a处的试纸变红 B、b电极是正极 C、a处发生的电极反应: D、b处发生的电极反应: -
8. 用所给试剂与图示装置能够制取相应气体的是(夹持仪器略)( )
选项
A
B
C
D

X
稀硫酸
浓硫酸
双氧水
浓氨水
Y
NaOH
气体
A、A B、B C、C D、D -
9. 在恒温密闭容器中发生反应: ( ),反应达到平衡后, 时缩小容器体积,x随时间(t)变化的关系如图所示。x不可能是( )
 A、V逆(逆反应速率) B、ρ(容器内气体密度) C、m(容器内CaO质量) D、c( 浓度)
A、V逆(逆反应速率) B、ρ(容器内气体密度) C、m(容器内CaO质量) D、c( 浓度) -
10. NA为阿伏加德罗常数的值,下列说法错误的是( )A、1mol月球表面的氦 含有的质子数为2NA B、15g乙酸与甲酸甲酯的混合物中含氧原子总数为0.5NA C、2mol 和1mol 催化反应后分子总数为2NA D、物质的量均为1mol的 和 中所含阴离子数均为NA
-
11. 为防止废弃的硒单质(Se)造成环境污染,通常用浓硫酸将其转化成SeO2 , 再用KI溶液处理后回收Se。发生反应:①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;②SeO2+4KI+4HNO3=4KNO3+Se+2I2+2H2O,下列说法正确的是( )A、①中SO2是氧化产物,SeO2是还原产物 B、②中HNO3是氧化剂,KI是还原剂 C、由①②可知浓硫酸能将KI氧化生成I2 D、由①②可知还原性由强到弱的顺序:Se>KI>SO2
-
12. 下表中物质的分类完全正确的是( )
选项
A
B
C
D
强电解质
弱电解质
HClO
非电解质
Al
A、A B、B C、C D、D -
13. 合成氨及其相关工业中,部分物质间的转化关系如图所示,下列说法错误的是( )
 A、I、Ⅱ、III和IV都属于氧化还原反应 B、I、Ⅱ、III和IV都是氮的固定 C、反应Ⅵ的部分产物可在流程中循环利用 D、反应Ⅴ的化学方程式为NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
A、I、Ⅱ、III和IV都属于氧化还原反应 B、I、Ⅱ、III和IV都是氮的固定 C、反应Ⅵ的部分产物可在流程中循环利用 D、反应Ⅴ的化学方程式为NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl -
14. 常温下,向10mL 0.1mol·L-1 CH3COOH溶液中逐滴滴入0.1 mol·L-1的某碱ROH溶液,所得溶液pH及导电性变化如图所示。下列分析错误的是( )
 A、b点溶液的pH=7,此时酸碱恰好中和 B、b点导电能力最强,说明ROH为强碱 C、c点溶液存在c(R+)>c(CH3COO-)、c(OH-)>c(H+) D、b~c任意点溶液均有c(H+)·c(OH-)= Kw=10-14
A、b点溶液的pH=7,此时酸碱恰好中和 B、b点导电能力最强,说明ROH为强碱 C、c点溶液存在c(R+)>c(CH3COO-)、c(OH-)>c(H+) D、b~c任意点溶液均有c(H+)·c(OH-)= Kw=10-14 -
15. 下列解释实验事实的离子方程式较合理的是( )A、用Na2S处理含Hg2+的废水: B、用氢氧化钠溶液去除铝条表面的氧化膜: C、用Na2SO3溶液吸收少量氯气: D、草木灰不能与铵态氮肥混合使用:
-
16. 将新制氯水加入下列溶液中,得到无色溶液的是( )A、AgNO3溶液 B、FeCl2溶液 C、NaBr溶液 D、石蕊试液
-
17. 已知四种盐的溶解度(S)曲线如下图所示,下列说法错误的是( )
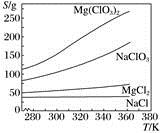 A、将NaCl溶液蒸干可得NaCl固体 B、将MgCl2溶液蒸干可得MgCl2固体 C、Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯 D、可用MgCl2和NaClO3制备Mg(ClO3)2
A、将NaCl溶液蒸干可得NaCl固体 B、将MgCl2溶液蒸干可得MgCl2固体 C、Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯 D、可用MgCl2和NaClO3制备Mg(ClO3)2 -
18. 一定条件下氨气和氯气反应的能量与反应过程如图所示,下列说法正确的是( )
 A、相同条件下Cl2比HCl稳定 B、过程I:断裂极性键和非极性键 C、过程Ⅱ:形成极性键和非极性键 D、热化学方程式为NH3(g)+Cl2(g)→NH2Cl(g)+HCl(g) △H=+11.3KJ
A、相同条件下Cl2比HCl稳定 B、过程I:断裂极性键和非极性键 C、过程Ⅱ:形成极性键和非极性键 D、热化学方程式为NH3(g)+Cl2(g)→NH2Cl(g)+HCl(g) △H=+11.3KJ -
19. 已知W、X、Y、Z均为短周期元素,常温下它们的最高价氧化物对应的水化物溶液(浓度均为0.01 )的pH和原子半径、原子序数的关系如图所示。下列说法正确的是( )
 A、单质的氧化性: B、简单气态氢化物的热稳定性: C、简单离子半径: D、X与Z的最高化合价之和为8
A、单质的氧化性: B、简单气态氢化物的热稳定性: C、简单离子半径: D、X与Z的最高化合价之和为8 -
20. 研究电化学腐蚀及防护的装置如下图所示。下列有关说法错误的是( )
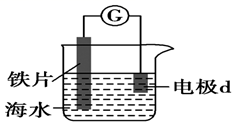 A、d为石墨,铁片腐蚀加快 B、d为石墨,石墨上电极反应为O2+2H2O+4e‒=4OH‒ C、d为锌块,铁片不易被腐蚀 D、d为锌块,锌块上电极反应为2H++2e‒=H2↑
A、d为石墨,铁片腐蚀加快 B、d为石墨,石墨上电极反应为O2+2H2O+4e‒=4OH‒ C、d为锌块,铁片不易被腐蚀 D、d为锌块,锌块上电极反应为2H++2e‒=H2↑
二、综合题
-
21. 中国“奋斗者”号深潜器研制及海试的成功,在钛合金材料制备、锂离子电池等方面实现了重大突破。(1)、深潜器的壳体由含钛、铝等元素的Ti-62A钛合金材料制成,该合金材料的熔点比组成成分的金属(选填“高”或“低”);铝元素的原子核外共有种不同能级的电子;以下方法可以比较钠和铝金属性强弱的方法。
a.比较两种金属单质的硬度和熔点
b.用钠置换氯化镁溶液中的镁
c.比较等物质的量的两种金属单质和足量盐酸反应失去的电子数
d.将空气中放置已久的这两种元素的单质分别和热水作用
e.在氯化铝溶液中逐滴滴加过量的氢氧化钠溶液
(2)、氮氧化铝((AlON)是一种高硬度、耐高温的防弹材料,属于晶体,Al、O、N三种元素的简单离子半径由大到小的排列顺序是(3)、明矾[ ]溶液中离子浓度从大到小的顺序为。 固体能除去镁盐溶液中的 ,原因是。(用离子方程式表达)(4)、在周期表中,锂的性质与镁相似,写出锂在氧气中燃烧产物的电子式(5)、已知: (M代表碱金属元素)元素
Li
Na
K
Rb
Q(kJ)
从原子结构的角度解释上述金属Q值递变的原因:。
-
22. 乙酸乙酯是一种用途广泛的精细化工产品,一般通过乙酸和乙醇酯化合生成。(1)、在实验室利用上述方法制得乙酸乙酯含有杂质(不计副反应),简述如何提纯产品。(2)、若用 标记乙醇,该反应的化学方程式。(3)、一定温度下该反应的平衡常数 。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率 (计算时不计副反应);若乙酸和乙醇的物质的量之比为 ,相应平衡体系中乙酸乙酯的物质的量分数为x,请绘制x随n变化的示意图。(4)、近年来,用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,具有明显的经济优势,其合成的基本反应为 ( )。在恒温恒容容器中投入一定量的乙烯和足量的乙酸,下列分析正确的是。
a.当乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol,反应已达到化学平衡
b.当乙烯的百分含量保持不变时,反应已达到化学平衡
c.在反应过程中任意时刻移除部分产品,都可以使平衡正向移动,但该反应的平衡常数不变
d.达到平衡后再通入少量乙烯,再次达到平衡时,乙烯的浓度大于原平衡
(5)、在乙烯与乙酸等物质的量投料条件下,某研究小组在不同压强、相同时间点进行了乙酸乙酯的产率随温度变化的测定实验,实验结果如图所示。回答下列问题: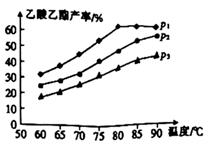
①温度在60~80℃范围内,乙烯与乙酸反应速率由大到小的顺序是[用 、 、 分别表示在不同压强下的反应速率]。
②在压强为 、温度超过80℃时,乙酸乙酯产率下降的原因可能是。
③为提高乙酸乙酯的合成速率和产率,可以采取的措施(任写两条)。
-
23. 阿特拉(H)是一种重要的抗过敏药,可减轻季节性过敏性鼻炎和慢性特发性荨麻疹引起的症状,可采用如下路线合成:

已知:Ph-代表苯基;
 。(1)、H中含氧官能团的名称为 , F→G的反应类型为。(2)、实验室检验B中官能团所用的试剂依次为。(3)、E→F的化学方程式为。(4)、D水解后得到物质W[
。(1)、H中含氧官能团的名称为 , F→G的反应类型为。(2)、实验室检验B中官能团所用的试剂依次为。(3)、E→F的化学方程式为。(4)、D水解后得到物质W[ ],写出同时满足下列条件的一种W的同分异构体的结构简式。
],写出同时满足下列条件的一种W的同分异构体的结构简式。 ①苯环上有两个取代基
②与Na反应产生氢气
③能发生银镜反应
④有5种化学环境不同的氢原子,且氢原子个数比为6∶2∶2∶1∶1
(5)、新戊酸( )可用于生产香料,利用题目信息设计由乙烯为原料制备新戊酸的合成路线。
)可用于生产香料,利用题目信息设计由乙烯为原料制备新戊酸的合成路线。 -
24. 草酸铁钾 (Fe为 价)为亮绿色晶体,易溶于水,难溶于乙醇、丙酮等有机溶剂,110℃失去结晶水,230℃分解,见光易分解,是一种军用光敏材料。实验室可以用如下的方法来制备这种材料并测定这种材料的组成和性质。(1)、Ⅰ.制备

“系列操作”依次为:恒温80℃加热蒸发→→→→→→三草酸合铁酸钾晶体粗产品。(填字母)
a.过滤
b.避光晾干
c.冰水浴冷却热饱和溶液
d.用95%的乙醇溶液洗涤晶体
e.加热至溶液表面出现亮绿色晶体,停止加热
(2)、结晶时应将饱和溶液用冰水冷却,同时放在黑暗处等待晶体的析出,这样操作的原因是。(3)、Ⅱ.组成测定。称取一定质量的晶体置于锥形瓶中,加入足量蒸馏水和稀 ,将 转化为 后用0.1000 溶液滴定,当消耗 溶液24.00mL时恰好完全反应( );向反应后的溶液中加入适量锌粉,至黄色刚好消失,此时溶液仍呈酸性;再用相同浓度的 溶液继续滴定,用去 溶液4.00mL。配制100mL 0.1000 溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、量筒、锥形瓶外还有(填仪器名称),加入锌粉的目的是。
(4)、第二次滴定的离子方程式为:。_ _ _
 →_ _ _
→_ _ _ 
第二次滴定终点的现象。
(5)、通过计算确定 中, , 。(6)、Ⅲ.探究草酸铁钾的光敏性。查阅资料得知草酸铁钾晶体光解与其溶液光解原理相似,X射线研究表明其光解后的残留固体为两种草酸盐。取草酸铁钾溶液按如图所示装置进行实验,观察到A中产生浅黄色沉淀和无色气体,B中变浑浊,推测浅黄色沉淀中铁元素的化合价为。

