上海市虹口区2021年高考化学二模试卷
试卷更新日期:2021-05-24 类型:高考模拟
一、单选题
-
1. 石油化学工业是国民经济重要支柱之一,下列有关石油化工的叙述错误的是( )
A
B
C
D




石油分馏是利用各组分沸点不同
石油裂化过程会发生碳碳键断裂
聚丙烯防护服材料易被KMnO4氧化
沥青可用于铺设马路
A、A B、B C、C D、D2. 实验室用碳化钙与水反应制备乙炔,相关化学用语表示正确的是( )A、水的电子式:H+[ ]2-H+
B、乙炔的结构式:CH CH
C、钙离子的结构示意图:
]2-H+
B、乙炔的结构式:CH CH
C、钙离子的结构示意图:  D、碳原子的电子排布式:1s22s22p2
3. 下列物质的水溶液因水解而呈碱性的是( )A、NH3 B、Na2S C、KOH D、NH4Cl4. 向溴水中加入或通入足量下列物质,最终不能得到无色溶液的是( )A、二氧化硫 B、氢氧化钠溶液 C、碘化钾溶液 D、热空气5. 含有极性键的非极性分子是( )A、SiO2 B、CO2 C、N2 D、NaOH6. 下列除杂方法正确的是(括号中为杂质)( )A、Al2O3(Fe2O3):盐酸,过滤 B、硝基苯(苯):蒸馏 C、己烷(己烯):加溴水,分液 D、CO2(SO2):饱和Na2CO3溶液,洗气7. 某烃结构如图所示,其系统命名应为( )
D、碳原子的电子排布式:1s22s22p2
3. 下列物质的水溶液因水解而呈碱性的是( )A、NH3 B、Na2S C、KOH D、NH4Cl4. 向溴水中加入或通入足量下列物质,最终不能得到无色溶液的是( )A、二氧化硫 B、氢氧化钠溶液 C、碘化钾溶液 D、热空气5. 含有极性键的非极性分子是( )A、SiO2 B、CO2 C、N2 D、NaOH6. 下列除杂方法正确的是(括号中为杂质)( )A、Al2O3(Fe2O3):盐酸,过滤 B、硝基苯(苯):蒸馏 C、己烷(己烯):加溴水,分液 D、CO2(SO2):饱和Na2CO3溶液,洗气7. 某烃结构如图所示,其系统命名应为( ) A、五甲基十一烷 B、1,2,2,6-四甲基庚烷 C、3,3,7-三甲基辛烷 D、2,6,6-三甲基辛烷8. 下列物质不能用于吸收H2S的是( )A、NaOH溶液 B、FeSO4溶液 C、CuCl2溶液 D、酸性KMnO4溶液9. 下列物质转化路线符合工业生产实际的是( )A、 B、淀粉 C、 D、饱和NaCl溶液 NaHCO3晶体10. 短周期元素W、X、Y和Z在元素周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )
A、五甲基十一烷 B、1,2,2,6-四甲基庚烷 C、3,3,7-三甲基辛烷 D、2,6,6-三甲基辛烷8. 下列物质不能用于吸收H2S的是( )A、NaOH溶液 B、FeSO4溶液 C、CuCl2溶液 D、酸性KMnO4溶液9. 下列物质转化路线符合工业生产实际的是( )A、 B、淀粉 C、 D、饱和NaCl溶液 NaHCO3晶体10. 短周期元素W、X、Y和Z在元素周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )W
X
Y
Z
A、非金属性:W > X B、简单离子的半径:Y < X C、气态氢化物的热稳定性:W > X D、最高价氧化物对应水化物的酸性:Y > W11. 在指定溶液中下列离子能大量共存的是( )A、透明澄清的溶液:NH 、Fe3+、SO 、NO B、能使甲基橙变红的溶液:Na+、Ca2+、AlO 、Cl- C、c(ClO-)=0.1mol/L的溶液:K+、Na+、CO 、S2- D、加入Al能放出H2的溶液:Mg2+、NH 、HCO 、NO12. 下列关于氯气的实验装置能达到实验目的的是( )A
B
C
D


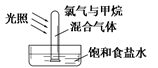

干燥氯气
收集氯气
探究氯气与甲烷的反应
证明氯气具有漂白性
A、A B、B C、C D、D13. 一种自修复材料在外力破坏后能够复原,其结构简式(图1)和修复原理(图2)如图所示,下列说法错误的是( ) A、该高分子可通过加聚反应合成 B、使用该材料时应避免接触强酸或强碱 C、合成该高分子的两种单体含有相同的官能团 D、自修复过程中“-COOCH2CH2CH2CH3”基团之间形成了化学键14. 图是离子交换膜电解槽,电解饱和食盐水时,离子交换膜只允许阳离子通过,下列说法错误的是( )
A、该高分子可通过加聚反应合成 B、使用该材料时应避免接触强酸或强碱 C、合成该高分子的两种单体含有相同的官能团 D、自修复过程中“-COOCH2CH2CH2CH3”基团之间形成了化学键14. 图是离子交换膜电解槽,电解饱和食盐水时,离子交换膜只允许阳离子通过,下列说法错误的是( ) A、a是电源的正极 B、X处产生的是氯气 C、可用铁作电极A的材料 D、Z处流出溶液是较浓的NaOH溶液15. 向等物质的量浓度的Ba(OH)2与BaCl2的混合溶液中加入NaHCO3溶液,下列离子方程式与事实相符的是( )A、HCO + OH-= CO +H2O B、Ba2+ + HCO + OH- = BaCO3↓+ H2O C、Ba2+ + 2HCO + 2OH-=BaCO3↓+ CO + 2H2O D、2Ba2++3HCO + 3OH- = 2BaCO3↓+ CO + 3H2O16. 双碱法脱硫过程如图所示,下列说法错误的是( )
A、a是电源的正极 B、X处产生的是氯气 C、可用铁作电极A的材料 D、Z处流出溶液是较浓的NaOH溶液15. 向等物质的量浓度的Ba(OH)2与BaCl2的混合溶液中加入NaHCO3溶液,下列离子方程式与事实相符的是( )A、HCO + OH-= CO +H2O B、Ba2+ + HCO + OH- = BaCO3↓+ H2O C、Ba2+ + 2HCO + 2OH-=BaCO3↓+ CO + 2H2O D、2Ba2++3HCO + 3OH- = 2BaCO3↓+ CO + 3H2O16. 双碱法脱硫过程如图所示,下列说法错误的是( ) A、过程I中,SO2未被氧化 B、过程Ⅱ中,1 mol O2可氧化2 mol Na2SO3 C、双碱法脱硫过程中,Ca(OH)2可以循环利用 D、总反应为2Ca(OH)2 + 2SO2 + O2 →2CaSO4+2H2O17. 饱和氯化钠溶液中存在如图所示过程,下列说法正确的是( )
A、过程I中,SO2未被氧化 B、过程Ⅱ中,1 mol O2可氧化2 mol Na2SO3 C、双碱法脱硫过程中,Ca(OH)2可以循环利用 D、总反应为2Ca(OH)2 + 2SO2 + O2 →2CaSO4+2H2O17. 饱和氯化钠溶液中存在如图所示过程,下列说法正确的是( ) A、a离子为Na+ , b离子为Cl- B、此过程中溶解速率大于结晶速率 C、再加入NaCl固体,溶质微粒浓度不变 D、此过程可以说明NaCl的电离:NaCl⇌Na++Cl-18. 测定一定质量小苏打中NaHCO3的含量(杂质为NaCl),下列实验方案不可行的是( )A、加热至恒重,称量剩余固体质量 B、加入足量稀硫酸,测定生成气体的体积 C、溶解后以甲基橙为指示剂,用标准盐酸溶液滴定 D、溶解后加入足量CaCl2溶液,过滤、洗涤、干燥后称量沉淀质量19. 我国科研人员提出了由小分子X、Y转化为高附加值产品M的催化反应历程。该历程可用示意图表示如图,下列说法错误的是( )
A、a离子为Na+ , b离子为Cl- B、此过程中溶解速率大于结晶速率 C、再加入NaCl固体,溶质微粒浓度不变 D、此过程可以说明NaCl的电离:NaCl⇌Na++Cl-18. 测定一定质量小苏打中NaHCO3的含量(杂质为NaCl),下列实验方案不可行的是( )A、加热至恒重,称量剩余固体质量 B、加入足量稀硫酸,测定生成气体的体积 C、溶解后以甲基橙为指示剂,用标准盐酸溶液滴定 D、溶解后加入足量CaCl2溶液,过滤、洗涤、干燥后称量沉淀质量19. 我国科研人员提出了由小分子X、Y转化为高附加值产品M的催化反应历程。该历程可用示意图表示如图,下列说法错误的是( ) A、①→②过程有热量放出 B、X、Y、M分别为甲烷、二氧化碳和乙酸 C、反应过程中有C-H键、C-C键、O-H键生成 D、由X、Y生成M的总反应原子利用率为100%20. I-具有还原性,含碘食盐中的碘元素以KIO3的形式存在,I-、I2、IO 在一定条件下可以发生如图转化关系,下列说法错误的是( )
A、①→②过程有热量放出 B、X、Y、M分别为甲烷、二氧化碳和乙酸 C、反应过程中有C-H键、C-C键、O-H键生成 D、由X、Y生成M的总反应原子利用率为100%20. I-具有还原性,含碘食盐中的碘元素以KIO3的形式存在,I-、I2、IO 在一定条件下可以发生如图转化关系,下列说法错误的是( ) A、由图可知氧化性的强弱顺序为Cl2 > IO > I2 B、用淀粉碘化钾试纸和白醋可检验食盐是否加碘 C、生产等量的碘,反应①和反应②转移电子数目之比为2∶5 D、反应③的离子方程式:3Cl2+ I-+3H2O →6Cl- + IO +6H+
A、由图可知氧化性的强弱顺序为Cl2 > IO > I2 B、用淀粉碘化钾试纸和白醋可检验食盐是否加碘 C、生产等量的碘,反应①和反应②转移电子数目之比为2∶5 D、反应③的离子方程式:3Cl2+ I-+3H2O →6Cl- + IO +6H+二、综合题
-
21. 镁元素在自然界分布广泛,是人体的必需元素之一。工业上可用硅热法(Pidgeon法)冶炼镁,以煅白(CaO·MgO,M = 96 g/mol)为原料与硅铁(含硅75%)混合置于密闭还原炉,1200℃下发生反应:2(CaO·MgO)(s) + Si(s)⇌Ca2SiO4 (l)+2Mg(g);完成下列填空:(1)、已知还原性Mg > Si,上述反应仍能发生的原因是。(2)、由图推测上述反应正向为(填“吸热”或“放热”)反应。
 (3)、若还原炉体积不变,能证明上述反应达到平衡的是(选填序号)。
(3)、若还原炉体积不变,能证明上述反应达到平衡的是(选填序号)。a.平衡常数到达最大值
b.反应物不再转化为生成物
c.炉内Ca2SiO4与CaO·MgO的质量比保持不变
d.单位时间内,n(CaO·MgO)消耗 :n(Ca2SiO4)生成 = 2:1
(4)、平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将(填“升高”“降低”或“不变”)。(5)、若还原炉容积为400 m3 , 原料中煅白质量为9600 kg,5小时后,测得煅白的转化率为50%,计算这段时间内Mg的生成速率 mol/(L·h)。(6)、工业上也可用电解法来制备镁。相关化合物的熔点如表所示:MgCl2
MgO
熔点/℃
712
2850
①镁原子核外有种能量不同的电子,它们的运动状态有种。
②MgCl2的电子式为;
③判断工业上应选择MgCl2还是MgO作为电解原料并说明理由
22. NaClO2是一种高效氧化剂和优质漂白剂,一种“二氧化氯泡腾片”有效成分为NaClO2、NaHCO3、NaHSO4 , 该泡腾片能快速溶于水,产生大量气泡,得到ClO2溶液。完成下列填空:(1)、“二氧化氯泡腾片”使用过程中产生ClO2的反应为:_ClO +_ _→_Cl- + _ClO2 +_H2O完成并配平上述化学方程式,标出电子转移方向与数目;氧化剂与还原剂的物质的量之比为。
(2)、“二氧化氯泡腾片”使用过程中“产生大量气泡”的离子方程式为:。(3)、常温下,向20 mL某新制氯水中逐滴滴入相同物质的量浓度的氢氧化钠溶液,pH变化与加入NaOH溶液体积关系(不考虑HClO分解)如图所示。
i.①→②过程中,水的电离程度的变化是。
ii.用离子方程式表示点③所示溶液中存在的水解平衡: 。
iii.在②点所示溶液中,用“>、<或 =”判断下列关系:
V1 40 mL;c(Cl-) c(ClO-) +c(HClO)。
三、有机推断题
-
23. 化合物M是一种天然产物合成中的重要中间体,其合成路线如图:

已知:
 +RCHO+
+RCHO+ 
完成下列填空:
(1)、写出反应类型:反应① 反应②(2)、写出X的结构简式:(3)、仅以B为单体形成的高分子的结构简式为。(4)、检验D中含有碳碳双键的实验方法是。(5)、写出同时满足下列条件的C的一种同分异构体的结构简式。ⅰ.含有苯环,分子中只含三种化学环境不同的氢原子
ⅱ.能发生银镜反应,1 mol该同分异构体最多能生成4 mol Ag
(6)、设计以 和
和  为原料制备
为原料制备  的合成路线。
的合成路线。 四、实验题
-
24. 葡萄糖酸亚铁(C6H11O7)2Fe(M=446g·mol-1)易溶于水,几乎不溶于乙醇,是常用的补铁剂。工业上制备葡萄糖酸亚铁的方法之一是用新制的碳酸亚铁与葡萄糖酸反应,其流程为:

完成下列填空:
(1)、反应Ⅰ的实验室模拟装置如图所示:
为成功制得碳酸亚铁,需依次进行如下操作,分析操作的目的:
操作
内容
目的
①
实验开始时先打开K1、K3 , 关闭K2
②
待B中反应即将结束时再打开K2 , 关闭K1、K3
(2)、反应Ⅰ结束后将浊液过滤,洗涤。写出检验碳酸亚铁是否洗净的实验操作。(3)、反应Ⅱ的化学方程式为(葡萄糖酸用化学式表示)。(4)、反应Ⅱ结束后加入葡萄糖酸调节溶液pH至5.8左右再进行结晶,目的是。结晶时加入乙醇可以提高葡萄糖酸亚铁的析出率,原因是。(5)、为测定(C6H11O7)2Fe·nH2O的结晶水数目,称取1.205 g晶体,在氢气流中加热至600℃使其完全分解,最终得到0.140 g铁单质。晶体中结晶水数目n =。若最终得到固体中含有少量Fe3+ , 则n的值(选填“偏大”“偏小”或“不变”)。
-