上海市崇明区2021年高考化学二模试卷
试卷更新日期:2021-05-24 类型:高考模拟
一、单选题
-
1. 在全国人民众志成城抗击新冠病毒期间,使用的“84消毒液”的主要有效成分是( )A、NaOH B、NaCl C、NaClO D、Na2CO32. 下列金属化合物中最方便用于潜水艇舱内供氧的是( )A、KMnO4 B、KClO3 C、KNO3 D、Na2O23. 下列含有共价键的盐是( )A、CaCl2 B、H2SO4 C、Ba(OH)2 D、Na2CO34. 蒸馏操作中需要用到的仪器是( )A、
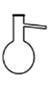 B、
B、 C、
C、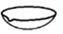 D、
D、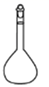 5. 有关碳元素及其化合物的化学用语正确的是( )A、CO2的电子式:
5. 有关碳元素及其化合物的化学用语正确的是( )A、CO2的电子式: B、C原子最外层电子的轨道表示式:
B、C原子最外层电子的轨道表示式:  C、醋酸的分子式:CH3COOH
D、乙烯的比例模型:
C、醋酸的分子式:CH3COOH
D、乙烯的比例模型:  6. 下列各组物质充分反应后,只能得到一种气体的是( )A、木炭和浓硫酸共热 B、足量的铜跟一定量的浓硝酸反应 C、Na2O2与足量的稀硫酸反应 D、汽油在汽车发动机中燃烧后排出的气体7. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、1 mol CH2=CH2分子中含有的共价键数为6NA B、500 mL 0.5 mol·L−1的NaCl溶液中微粒数大于0.5NA C、30 g HCHO与CH3COOH混合物中含C原子数为NA D、2.3 g Na与O2完全反应,反应中转移的电子数介于0.1NA和0.2NA之间8. 下列有关物质的性质与用途具有对应关系的是( )A、铝的金属活泼性强,可用于制作铝金属制品 B、氧化铝熔点高,可用作电解冶炼铝的原料 C、氢氧化铝受热分解,可用于中和过多的胃酸 D、明矾溶于水并水解形成胶体,可用于净水9. 在溶液中加入少量Na2O2后仍能大量共存的离子组是( )A、 、 、 、 B、 、 、 、 C、 、 、 、 D、 、 、 、10. 室温下,下来事实不能说明NH3·H2O为弱电解质的是( )A、0.1 mol·L-1NH3·H2O的pH小于13 B、0.1 mol·L-1 NH4Cl溶液的pH小于7 C、相同条件下,浓度均为0.1 mol·L-1 NaOH溶液和氨水,氨水的导电能力弱 D、0.1 mol·L-1NH3·H2O能使无色酚酞试液变红色11. 化学家Tim Richard将分子结构像小狗的某有机物(如图所示)取名为“doggycene”——“狗烯”,其化学式为C26H26 , 下列有关该“狗烯”物质的叙述正确的是( )
6. 下列各组物质充分反应后,只能得到一种气体的是( )A、木炭和浓硫酸共热 B、足量的铜跟一定量的浓硝酸反应 C、Na2O2与足量的稀硫酸反应 D、汽油在汽车发动机中燃烧后排出的气体7. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、1 mol CH2=CH2分子中含有的共价键数为6NA B、500 mL 0.5 mol·L−1的NaCl溶液中微粒数大于0.5NA C、30 g HCHO与CH3COOH混合物中含C原子数为NA D、2.3 g Na与O2完全反应,反应中转移的电子数介于0.1NA和0.2NA之间8. 下列有关物质的性质与用途具有对应关系的是( )A、铝的金属活泼性强,可用于制作铝金属制品 B、氧化铝熔点高,可用作电解冶炼铝的原料 C、氢氧化铝受热分解,可用于中和过多的胃酸 D、明矾溶于水并水解形成胶体,可用于净水9. 在溶液中加入少量Na2O2后仍能大量共存的离子组是( )A、 、 、 、 B、 、 、 、 C、 、 、 、 D、 、 、 、10. 室温下,下来事实不能说明NH3·H2O为弱电解质的是( )A、0.1 mol·L-1NH3·H2O的pH小于13 B、0.1 mol·L-1 NH4Cl溶液的pH小于7 C、相同条件下,浓度均为0.1 mol·L-1 NaOH溶液和氨水,氨水的导电能力弱 D、0.1 mol·L-1NH3·H2O能使无色酚酞试液变红色11. 化学家Tim Richard将分子结构像小狗的某有机物(如图所示)取名为“doggycene”——“狗烯”,其化学式为C26H26 , 下列有关该“狗烯”物质的叙述正确的是( )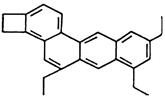 A、“狗烯”能燃烧,燃烧时可能会有黑烟冒出 B、“狗烯”分子中所有碳原子一定共平面 C、“狗烯”的一氯代物有14种(不含立体异构) D、“狗烯”能发生加成反应、氧化反应,不能发生取代反应12. 关于晶体的叙述中,正确的是( )A、原子晶体中,共价键的键能越大,熔、沸点越高 B、分子晶体中,分子间的作用力越大,该分子越稳定 C、分子晶体中,共价键的键能越大,熔、沸点越高 D、某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体13. 在合成氨、硫酸、纯碱的工业生产流程中,具有的共同点是( )A、原料气循环使用 B、使用热交换器 C、原料气净化 D、加热14. 下列事实不能用平衡移动原理解释的是( )A、
A、“狗烯”能燃烧,燃烧时可能会有黑烟冒出 B、“狗烯”分子中所有碳原子一定共平面 C、“狗烯”的一氯代物有14种(不含立体异构) D、“狗烯”能发生加成反应、氧化反应,不能发生取代反应12. 关于晶体的叙述中,正确的是( )A、原子晶体中,共价键的键能越大,熔、沸点越高 B、分子晶体中,分子间的作用力越大,该分子越稳定 C、分子晶体中,共价键的键能越大,熔、沸点越高 D、某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体13. 在合成氨、硫酸、纯碱的工业生产流程中,具有的共同点是( )A、原料气循环使用 B、使用热交换器 C、原料气净化 D、加热14. 下列事实不能用平衡移动原理解释的是( )A、 开启啤酒瓶后,瓶中马上泛起大量泡沫
B、
开启啤酒瓶后,瓶中马上泛起大量泡沫
B、 由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色变深
C、
由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色变深
C、 实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出
D、
实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出
D、 石灰岩受地下水长期溶蚀形成溶洞
15. 下列离子方程式书写正确的是( )A、钠投入水中的离子方程式:Na + 2H2O= + + H2↑ B、氯气溶于水的离子方程式:Cl2 + H2O = + + C、制印刷电路板的反应: + Cu = + D、Ba(OH)2溶液中加入过量的NaHSO4溶液: + + + = BaSO4↓ + 2H2O16. 在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,如图所示。下列说法正确的是( )
石灰岩受地下水长期溶蚀形成溶洞
15. 下列离子方程式书写正确的是( )A、钠投入水中的离子方程式:Na + 2H2O= + + H2↑ B、氯气溶于水的离子方程式:Cl2 + H2O = + + C、制印刷电路板的反应: + Cu = + D、Ba(OH)2溶液中加入过量的NaHSO4溶液: + + + = BaSO4↓ + 2H2O16. 在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,如图所示。下列说法正确的是( ) A、X是阳极 B、Y极发生还原反应 C、该装置将电能转化为化学能 D、X极的电极反应为:Fe2+-e → Fe3+17. 碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
A、X是阳极 B、Y极发生还原反应 C、该装置将电能转化为化学能 D、X极的电极反应为:Fe2+-e → Fe3+17. 碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:①H2(g) + I2(?) 2HI(g)+9.48kJ
②H2(g) + I2(?) 2HI(g)-26.48kJ
下列判断正确的是( )
A、①中的I2为固态,②中的I2为气态 B、②的反应物总能量比①的反应物总能量低 C、①的产物比反应②的产物热稳定性更好 D、1mol 固态碘升华时将吸热17kJ18. 某无色溶液中可能含有 、 、 、 ,向该溶液中加入少量溴水,溶液呈无色,则下列关于溶液组成的判断正确的是①肯定不含 ②肯定不含 ③肯定含有 ④可能含有 .
A、①③ B、①②③ C、③④ D、②③④19. “封管实验”具有简易、方便、节约、绿色等优点,关于如图所示三个“封管实验”(夹持装置未画出)的说法正确的是( ) A、加热时,①中上部汇集了 固体 B、加热时,②中溶液变红,冷却后又变为无色 C、加热时,③中溶液红色褪去,冷却后溶液变红,体现 的漂白性 D、三个“封管实验”中所发生的化学反应都是可逆反应20. 与苯乙酸(C6H5CH2COOH)是同分异构体关系且属于芳香酯类的结构有( )A、4种 B、5种 C、6种 D、7种
A、加热时,①中上部汇集了 固体 B、加热时,②中溶液变红,冷却后又变为无色 C、加热时,③中溶液红色褪去,冷却后溶液变红,体现 的漂白性 D、三个“封管实验”中所发生的化学反应都是可逆反应20. 与苯乙酸(C6H5CH2COOH)是同分异构体关系且属于芳香酯类的结构有( )A、4种 B、5种 C、6种 D、7种二、综合题
-
21. 某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
提出问题: 、Br2哪个氧化性更强?
(1)、猜想:①甲同学认为氧化性: >Br2 , 故上述实验现象不是发生氧化还原反应所致,则溶液呈黄色是含(填化学式,下同)所致。②乙同学认为氧化性:Br2> ,故上述现象是发生氧化还原反应所致,则溶液呈黄色是含所致。(2)、设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的。供选用的试剂:a.酚酞试液 b.CCl4 c.无水酒精 d.KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象。
选用试剂(填序号)
实验现象
方案1
方案2
(3)、结论:氧化性Br2> 。故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为。实验后的思考:根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是。
某实验室用含少量铁的废铜渣为原料生产胆矾的流程如下:
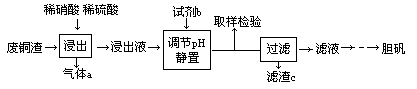
已知: 在pH为2.7时开始沉淀,到3.7时沉淀完全; 在pH为4.7时开始沉淀。
(4)、“浸出”时,原料中的铜均转化为硫酸铜。写出相应的离子方程式:。(5)、试剂b是(填物质名称),其反应的离子方程式:。(6)、调节pH的目的是。滤渣c是。(7)、将得到的胆矾与其他液体混合物分离的方法为。22. 分解水制氢气的工业制法之一是硫—碘循环,主要涉及下列反应:(I)SO2 + 2H2O + I2 → H2SO4 + 2HI,(II)2HI H2 + I2 , (III)2H2SO4 → 2SO2 + O2 + 2H2O
(1)、分析上述反应,下列判断正确的是a.反应III易在常温下进行 b.反应I中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1mol O2的同时产生1mol H2
(2)、一定温度下,向2L密闭容器中加入1mol HI(g),发生反应II,H2物质的量随时间的变化如图所示。0-2min内的平均反应速率v(HI)= 。该温度下,反应2HI(g) H2(g) + I2(g)的平衡常数表达式为。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则(从a~d中选择)是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)、SO2在一定条件下可氧化生成SO3 , 其主反应为:2SO2 (g) + O2(g) 2SO3(g) + Q,若此反应起始的物质的量相同,则下列关系图正确的是(填序号)a.
 b
b 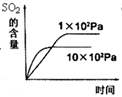
c.
 d.
d. 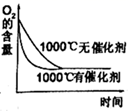
实际工业生产使用的条件是:常压、。
(4)、实际生产用氨水吸收SO2生成亚硫酸的铵盐。现取a克该铵盐,若将其中的铵盐全部反应生成SO2 , 应加入18.4mol/L的硫酸溶液的体积(V)范围为L(只列出算式即可)。23. 在短周期元素中有部分元素的原子具有核外电子排布有2个未成对电子的特点。具有这样特点的元素中:(1)、A元素原子的半径最大,写出A在元素周期表中的位置 , 其原子核外电子排布式为 , A与上述元素中原子半径最小的元素B形成的化合物晶体类型为。(2)、C元素的单质能溶解于C与D形成的化合物中,写出该化合物的分子式 , 推断该化合物(难、微、易)溶于水。(3)、C、D元素均可与B元素形成化合物,此2种化合物都可与水反应形成对应的酸,2种酸的分子式相似,写出2种酸的分子式 , 简述证明2种酸酸性相对强弱的方法。Cu2S和CuS均可被KMnO4酸性溶液氧化,在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① + Cu2S + → + SO2↑ + + H2O(未配平)
② + CuS + → + SO2↑ + + H2O(未配平)
(4)、下列关于反应①的说法中错误的是(选填编号)。a.还原性的强弱关系是: > Cu2S
b.氧化剂与还原剂的物质的量之比为
c.生成2.24L(标况下)SO2 , 转移电子的物质的量是0.8mol
d.被氧化的元素是正一价的Cu和负二价的S
(5)、写出反应②中反应物配平后的系数并标出电子转移方向和数目:_ +_CuS +_
已知:KMnO4在稀硫酸存在下能将H2O2氧化为O2 , KMnO4被还原为 ;H2O2在前面反应生成 的催化下能发生分解反应生成H2O和O2。
(6)、稀硫酸中,某KMnO4和H2O2发生氧化还原反应方程式如下:2KMnO4 + 7H2O2 + 3H2SO4 → K2SO4 + 2MnSO4 + 6O2↑ + 10H2O,反应中1mol KMnO4氧化H2O2的物质的量是mol, 反应中的氧化剂是 , 氧化剂与还原剂的物质的量比为。
三、有机推断题
-
24. 某高中化学创新兴趣小组运用所学知识并参考相关文献,设计了一种“绿原酸”的合成路线如图:

已知:①
 +
+ 
 ;②
;②  +R2-OH
+R2-OH 
回答下列问题:
(1)、有机物A用足量氢气催化加成后所得有机物的名称是。(2)、有机物B的结构简式为。(3)、反应①的反应类型是。(4)、写出A物质发生1, 4-加聚的反应方程式。(5)、有机物F中官能团的名称是醚键、、。反应②的目的是。(6)、反应D→E中第(1)步的反应方程式是。(7)、参照上述合成方法,设计由丙酸为原料制备高吸水性树脂聚丙烯酸钠的合成路线 (无机试剂任选,合成路线常用的表达方式为: ( )。
)。