安徽省江南十校2021年高考化学一模试卷
试卷更新日期:2021-05-24 类型:高考模拟
一、单选题
-
1. 中国古代炼丹术促进了金属冶炼技术的发展。唐代《丹房镜源》中记载了炼制铅丹的方法:“熔铅成汁,下醋点之,滚沸时下硫一小块,续下硝少许······炒为末,成黄丹胡粉。”下列叙述正确的是( )A、上述过程中发生了置换反应 B、“滚沸”中仅有物理变化 C、“硝”是指硝酸 D、“黄丹胡粉”是纯净物2. 粗盐(含泥沙、CaCl2、MgSO4等)提纯得到的NaCl溶液中仍含有少量K+ , 需进一步提纯才可得到试剂级氯化钠,实验装置如图所示(已知:NaCl+H2SO4(浓) HCl↑+NaHSO4).下列叙述错误的是( )
 A、粗盐提纯实验需要NaOH溶液、BaCl2溶液、Na2CO3溶液、HCl溶液 B、关闭止水夹K,打开分液漏斗活塞,若液体不滴落,证明a中气密性良好 C、实验过程中,c中有固体析出 D、d中加入NaOH溶液吸收尾气3. 阿霉素是一种抗肿瘤药物:阿霉酮是生产阿霉素的中间体,其结构如图所示:下列说法正确的是( )
A、粗盐提纯实验需要NaOH溶液、BaCl2溶液、Na2CO3溶液、HCl溶液 B、关闭止水夹K,打开分液漏斗活塞,若液体不滴落,证明a中气密性良好 C、实验过程中,c中有固体析出 D、d中加入NaOH溶液吸收尾气3. 阿霉素是一种抗肿瘤药物:阿霉酮是生产阿霉素的中间体,其结构如图所示:下列说法正确的是( ) A、阿霉酮分子式为C21H18O9 B、阿霉酮分子中所有的碳原子都在同一个平面上 C、1 mol 阿霉酮最多可与8mol H2发生加成反应 D、阿霉酮可与Na2CO3溶液反应生成CO2气体4. HNO2与羟基自由基(·OH)的气相氧化反应与酸雨、光化学烟雾等重大环境问题密切相关。水分子可作为该气相氧化反应的催化剂,图中表示水分子催化的一种机理:下列叙述错误的是( )
A、阿霉酮分子式为C21H18O9 B、阿霉酮分子中所有的碳原子都在同一个平面上 C、1 mol 阿霉酮最多可与8mol H2发生加成反应 D、阿霉酮可与Na2CO3溶液反应生成CO2气体4. HNO2与羟基自由基(·OH)的气相氧化反应与酸雨、光化学烟雾等重大环境问题密切相关。水分子可作为该气相氧化反应的催化剂,图中表示水分子催化的一种机理:下列叙述错误的是( ) A、该气相氧化反应的化学方程式为HNO2+·OH NO2+H2O B、反应历程中还可能形成HONO···H2O C、该反应历程中最大能垒(活化能)为201.1kJ·mol-1 D、
A、该气相氧化反应的化学方程式为HNO2+·OH NO2+H2O B、反应历程中还可能形成HONO···H2O C、该反应历程中最大能垒(活化能)为201.1kJ·mol-1 D、 是反应过渡态
5. 研究发现钾离子可在有机与无机材料层间脱嵌实现电池的充放电过程。如图所示是一种钾离子的二次电池模型。下列说法正确的是( )
是反应过渡态
5. 研究发现钾离子可在有机与无机材料层间脱嵌实现电池的充放电过程。如图所示是一种钾离子的二次电池模型。下列说法正确的是( )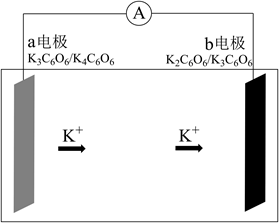 A、放电时,a为负极,碳元素化合价不变 B、放电时,转移0.2NA电子,正极增重7.8g C、充电时,b极反应为K2C6O6-e-+K+=K3C6O6 D、电池总反应为K4C6O6+K2C6O6 2K3C6O66. W、X、Y、Z为短周期主族元素且原子序数依次增大,W与Y同主族,X与Z同主族。其中X、Y、Z构成的某种物质结构如图所示。下列叙述正确的是( )
A、放电时,a为负极,碳元素化合价不变 B、放电时,转移0.2NA电子,正极增重7.8g C、充电时,b极反应为K2C6O6-e-+K+=K3C6O6 D、电池总反应为K4C6O6+K2C6O6 2K3C6O66. W、X、Y、Z为短周期主族元素且原子序数依次增大,W与Y同主族,X与Z同主族。其中X、Y、Z构成的某种物质结构如图所示。下列叙述正确的是( ) A、W与X形成的化合物是共价化合物 B、Y和Z形成的最简单化合物水溶液呈酸性 C、简单离子半径:Z>Y>X>W D、向该物质中加入稀硫酸,产生气泡和淡黄色沉淀7. 化学中常用AG表示溶液的酸度(AG=lg )。室温下,向20.00 mL0.1000 mol·L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与酸度AG随加人稀硫酸体积的变化如图所示。下列说法正确的是( )
A、W与X形成的化合物是共价化合物 B、Y和Z形成的最简单化合物水溶液呈酸性 C、简单离子半径:Z>Y>X>W D、向该物质中加入稀硫酸,产生气泡和淡黄色沉淀7. 化学中常用AG表示溶液的酸度(AG=lg )。室温下,向20.00 mL0.1000 mol·L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与酸度AG随加人稀硫酸体积的变化如图所示。下列说法正确的是( ) A、室温下MOH的电离常数Kb=1.0×10-6 B、当AG=0时,溶液中存在c(SO )>c(M+)>c(H+)=c(OH-) C、a点对应的溶液中:c(M+)+c(MOH)=8c(SO ) D、b、c、d三点对应的溶液中,水的电离程度大小关系:c>b=d
A、室温下MOH的电离常数Kb=1.0×10-6 B、当AG=0时,溶液中存在c(SO )>c(M+)>c(H+)=c(OH-) C、a点对应的溶液中:c(M+)+c(MOH)=8c(SO ) D、b、c、d三点对应的溶液中,水的电离程度大小关系:c>b=d二、综合题
-
8. 三氯氧磷(POCl3)和氯化亚砜(SOCl2)均为重要的化工产品。现以氯气、二氧化硫和三氯化磷为原料,采用二级间歇式反应装置联合制备三氯氧磷和氯化亚砜。实验过程中,控制氯气和二氧化硫通入的体积比为1:1.实验过程示意图如图:

已知:
名称
熔点/℃
沸点/℃
溶解性
理化性质
三氯氧磷
2
105.3
可溶于有机溶剂
遇水分解
氯化亚砜
-105
78.8
可溶于有机溶剂
遇水分解,加热分解
(1)、实验室制备氯气或二氧化硫时均可能用到的仪器有_______。A、温度计 B、酒精灯 C、分液漏斗 D、圆底烧瓶(2)、A装置的作用为:、、使气体充分混合。(3)、实验开始时需水浴加热,一段时间后改为冷水浴,其原因是。(4)、B中发生反应的化学方程式是。(5)、反应5~6小时后,暂停通入气体。将B瓶拆下,C瓶装在图中B瓶处,并在原C瓶处重新装上一个盛有PCl3的圆底烧瓶。继续通气反应一段时间后重复以上步骤,上述操作的优点是;B瓶中的物质可采用.(填实验方法)使其分离。(6)、已知反应前加入三氯化磷550g,最终得到357g氯化亚砜,则三氯氧磷的产率为。9. 实验室模拟工业回收电镀污水(主要含有Ni2+、Cu2+、Fe3+、Cr3+、Zn2+等)中铜和镍的工艺流程如图:
已知:
I:Cr(OH)3和Zn(OH)2是两性氢氧化物
II:室温下,Ni(OH)2的Ksp约为1.0×10-15
回答下列问题:
(1)、图(a)和图(b)分别是“置换”过程中“置换时间”和“铁粉加入量”(以理论需求量的倍数表示)对铜沉淀率和镍损失率的影响。“置换”过程选择的最佳时间和铁粉加入量为、。 (2)、滤液①中含有的阴离子为OH-、、。(3)、“氨解”的目的是。(4)、“氧化”时发生反应的离子方程式为.。要使Ni2+沉淀完全,“二次碱析”需调节溶液的pH至少为。(当溶液中离子浓度小于1.0×10-5mol·L-1时可视为沉淀完全)(5)、获得粗品硫酸镍时需进行的“系列操作”主要包括蒸发浓缩、、、洗涤、干燥。10. 含氮化合物对工业生产有多种影响。化学工作者设计了如下再利用的方案:(1)、以NH3和CO2为原料合成化肥-尿素[CO(NH2)2],两步反应的能量变化如图:
(2)、滤液①中含有的阴离子为OH-、、。(3)、“氨解”的目的是。(4)、“氧化”时发生反应的离子方程式为.。要使Ni2+沉淀完全,“二次碱析”需调节溶液的pH至少为。(当溶液中离子浓度小于1.0×10-5mol·L-1时可视为沉淀完全)(5)、获得粗品硫酸镍时需进行的“系列操作”主要包括蒸发浓缩、、、洗涤、干燥。10. 含氮化合物对工业生产有多种影响。化学工作者设计了如下再利用的方案:(1)、以NH3和CO2为原料合成化肥-尿素[CO(NH2)2],两步反应的能量变化如图:
写出合成CO(NH2)2(s)的热化学方程式 , 已知第二步反应决定了生产尿素的快慢,可推测E1E3(填“>”“<”或“=”)。
(2)、氨的催化氧化过程可发生以下两种反应,该过程易受催化剂选择性影响。1:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH<0;
II:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH<0;
在容积固定的密闭容器中充入1.5 mol NH3和1.55 mol O2 , 在催化剂作用下发生上述反应。生成物NO和N2的物质的量随温度的变化曲线如图。

①当温度处于400℃~840℃时,N2的物质的量减少,NO的物质的量增加,其原因是。
②840℃时,反应I中NH3的转化率为.(保留小数点后2位,下同);若520℃时起始压强为P0 , 恒温下反应II的平衡常数Kp=.(Kp为以分压表示的平衡常数)
(3)、借助电化学方法在含Cl-的水样中将NH 转化为N2 , 其原理是:利用电解产物转化生成的HClO氧化NH3;以达到脱氮的目的,HClO在电解池的(填“阴极”或“阳极”)附近产生。研究还发现:弱酸性溶液比强酸性溶液更有利于HClO的生成,请从化学平衡移动的角度解释其原因。11. 电动汽车电池材料的发展技术之一是使用三元材料镍锰钴酸锂。回答下列问题:(1)、基态Mn2+中成对电子数与未成对电子数之比为.。(2)、[Co(NO2)(NH3)5]Cl2中Co3+的配位数为 , 粒子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则配体中NO 的大π键可表示为 , 空间构型为。(3)、①已知:过渡金属价层达到18电子时,配位化合物较稳定。比较稳定性:[Ni(CO)4][Co(C5H5)2](填“>”“<”)。②正负离子的半径比是决定晶体结构和配位数的重要因素。根据图(a)、图(b)推测晶体中离子半径比(r+/r-)与配位数的关系.。
 (4)、镍锰钴酸锂三元材料为六方最密堆积,其晶胞结构如下图所示,以R表示过渡金属离子,其化学式为。若过渡金属离子的平均摩尔质量为MRg·mol-1 , 该晶体的密度是ρg·cm-3 , 阿伏加德罗常数是NA , 则NA=。(列出计算表达式)
(4)、镍锰钴酸锂三元材料为六方最密堆积,其晶胞结构如下图所示,以R表示过渡金属离子,其化学式为。若过渡金属离子的平均摩尔质量为MRg·mol-1 , 该晶体的密度是ρg·cm-3 , 阿伏加德罗常数是NA , 则NA=。(列出计算表达式) 12. 一种抗肿瘤药物H的合成路线如图所示,按要求回答问题:
12. 一种抗肿瘤药物H的合成路线如图所示,按要求回答问题: (1)、A的化学名称为。(2)、B的结构简式为。(3)、由C生成D的反应类型是。(4)、1 molD最多可与 mol NaOH反应。(5)、F生成G过程中反应①的化学方程式是。(6)、满足下列条件的A的芳香化合物同分异构体共有种(不考虑立体异构)。
(1)、A的化学名称为。(2)、B的结构简式为。(3)、由C生成D的反应类型是。(4)、1 molD最多可与 mol NaOH反应。(5)、F生成G过程中反应①的化学方程式是。(6)、满足下列条件的A的芳香化合物同分异构体共有种(不考虑立体异构)。①能与FeCl3发生显色反应;②能发生银镜反应和水解反应。
(7)、参照上述合成路线,设计一条由 制备
制备  的合成路线。(无机试剂任选)。
的合成路线。(无机试剂任选)。