安徽省黄山市2021年高考化学一模试卷
试卷更新日期:2021-05-24 类型:高考模拟
一、单选题
-
1. “白墙黛瓦马头墙,回廊挂落花格窗”是传统徽派建筑的特色,下列有关说法正确的是( )
 A、建房所用的“黛瓦”的青黑色是因为含有氧化铁的缘故 B、建房所用的青砖和日常陶瓷的主要成分均为碳酸盐 C、建房所用的木头主要成分是纤维素,纤维素和淀粉互为同分异构体 D、马头墙又称“封火墙”,主要作用之一是防火2. 铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
A、建房所用的“黛瓦”的青黑色是因为含有氧化铁的缘故 B、建房所用的青砖和日常陶瓷的主要成分均为碳酸盐 C、建房所用的木头主要成分是纤维素,纤维素和淀粉互为同分异构体 D、马头墙又称“封火墙”,主要作用之一是防火2. 铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是( )
A、CO也是该反应的催化剂 B、反应过程中Rh的成键数目有变化 C、CH3I是反应中间体 D、存在反应CH3COI+H2O=CH3CO2H+HI3. 吡啶( )也是一种芳香化合物(类似于苯),2—乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如下路线合成。下列叙述错误的是( )
)也是一种芳香化合物(类似于苯),2—乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如下路线合成。下列叙述错误的是( )  A、MPy除本身另有3种芳香同分异构体 B、EPy是乙醇的同系物 C、VPy分子中所有原子可能共平面 D、反应①的反应类型是加成反应4. 物质由高浓度向低浓度扩散而引发的一类电池称为浓差电池。如下图是由Ag电极和硝酸银溶液组成的电池(c1<c2),工作时,A电极的质量不断减轻,下列说法正确的是( )
A、MPy除本身另有3种芳香同分异构体 B、EPy是乙醇的同系物 C、VPy分子中所有原子可能共平面 D、反应①的反应类型是加成反应4. 物质由高浓度向低浓度扩散而引发的一类电池称为浓差电池。如下图是由Ag电极和硝酸银溶液组成的电池(c1<c2),工作时,A电极的质量不断减轻,下列说法正确的是( ) A、Ag+由交换膜右侧向左侧迁移 B、B极为正极,发生氧化反应 C、若外电路通过0.1mol电子,则右侧溶液减轻6.2g D、原电池的总反应不一定是氧化还原反应5. 下列图示实验说法正确的是( )A、过滤海带灰的浸泡液
A、Ag+由交换膜右侧向左侧迁移 B、B极为正极,发生氧化反应 C、若外电路通过0.1mol电子,则右侧溶液减轻6.2g D、原电池的总反应不一定是氧化还原反应5. 下列图示实验说法正确的是( )A、过滤海带灰的浸泡液 B、除去Cl2中的HCl
B、除去Cl2中的HCl  C、实验室制氯气
C、实验室制氯气  D、实验室制取氨气
D、实验室制取氨气  6. 某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,X、W为同族,Q原子核外最外层电子数与Y原子核外电子总数相同。下列叙述正确的是( )
6. 某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,X、W为同族,Q原子核外最外层电子数与Y原子核外电子总数相同。下列叙述正确的是( ) A、元素非金属性的顺序为:Q>Y>Z>X B、Z的氧化物对应的水化物是一种一元强酸 C、由X、Y、Q、W四种元素形成的化合物的水溶液可能呈酸性 D、ZX3可以使湿润的蓝色石蕊试纸变红7. 室温下,在25 mL某浓度的NaOH溶液中,逐滴加入0.1 mol·L-1醋酸,滴定曲线如图所示。则下列说法正确的是( )
A、元素非金属性的顺序为:Q>Y>Z>X B、Z的氧化物对应的水化物是一种一元强酸 C、由X、Y、Q、W四种元素形成的化合物的水溶液可能呈酸性 D、ZX3可以使湿润的蓝色石蕊试纸变红7. 室温下,在25 mL某浓度的NaOH溶液中,逐滴加入0.1 mol·L-1醋酸,滴定曲线如图所示。则下列说法正确的是( ) A、从A点到B点的过程中,溶液的导电能力几乎不变 B、a点对应的体积值等于25 mL C、C点时,c(Na+)>c(CH3COO-)>c(H+)>c(OH-) D、D点时,c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
A、从A点到B点的过程中,溶液的导电能力几乎不变 B、a点对应的体积值等于25 mL C、C点时,c(Na+)>c(CH3COO-)>c(H+)>c(OH-) D、D点时,c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)二、综合题
-
8. 治理氮氧化物(NOx)的污染是化学研究的重要课题之一。(1)、I.NO能被灼热的铁粉还原为N2 , 同时生成FeO,利用下列装置模拟该反应。
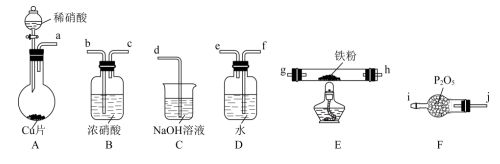
已知:①浓硝酸可将NO氧化为NO2;②NaOH溶液能与NO2反应,不与NO反应。
打开A装置分液漏斗活塞,烧瓶中观察到的实验现象有:铜片表面出现无色气泡,铜片逐渐变小、、烧瓶中溶液由无色变为蓝色。
(2)、上述装置接口的连接顺序为:a→→→→→g→h→b→c→d(按气流方向,用小写字母表示)。(3)、装置B的作用是。(4)、装置E中反应的化学方程式为。(5)、II.已知:(NOx)能与Na2O2反应;NO2和Na2O2都有较强氧化性。为探究NO2与Na2O2反应的产物,提出如下假设:假设①NO2氧化Na2O2;假设②Na2O2氧化NO2
甲同学设计如图所示实验装置:
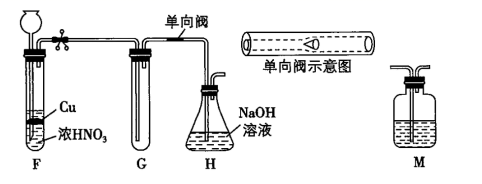
请回答下列问题:
甲乙两同学对假设分别进行了验证:
实验操作
现象
结论
甲同学
待试管G中收集满气体,向其中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管,观察现象;并将带火星的木条迅速伸进试管,观察。
红棕色气体迅速消失;木条复燃
假设①正确
乙同学
在F、G之间增加一个M洗气瓶,目的是 , 重复甲同学的实验操作。
红棕色气体迅速消失,带火星的木条未复燃
假设②正确
请做出正确判断,写出NO2和Na2O2反应的化学方程式。
(6)、图中单向阀在实现气体单向流通的同时,还有一个作用是。9. 2020年12月17日,中国探月工程嫦娥五号任务取得圆满成功。嫦娥五号锂离子蓄电池选用了比能量更高的钴酸锂(LiCoO2)正极材料和石墨负极材料。钴是一种稀有的贵重金属,废旧锂离子电池电极材料的回收再生意义重大,钴酸锂回收再生流程如图: (1)、用H2SO4酸浸时,通常需添加30%的H2O2以提高浸出效率,写出相应反应的化学方程式:。(2)、用盐酸代替H2SO4和H2O2 , 浸出效率也很高。但工业上不使用盐酸,主要原因是会产生有毒、有污染的气体(填化学式)。(3)、其他条件不变时,相同反应时间,随着温度升高,含钴酸锂的固体滤渣在H2SO4和30%的H2O2混合液中的浸出率如下表所示,请分析80℃时钴的浸出率最大的原因:。
(1)、用H2SO4酸浸时,通常需添加30%的H2O2以提高浸出效率,写出相应反应的化学方程式:。(2)、用盐酸代替H2SO4和H2O2 , 浸出效率也很高。但工业上不使用盐酸,主要原因是会产生有毒、有污染的气体(填化学式)。(3)、其他条件不变时,相同反应时间,随着温度升高,含钴酸锂的固体滤渣在H2SO4和30%的H2O2混合液中的浸出率如下表所示,请分析80℃时钴的浸出率最大的原因:。反应温度/℃
60
70
80
90
钴的浸出率/%
88
90.5
93
91
(4)、已知常温下草酸Ka1=5.6×10-2 , Ka2=1.5×10-4 , Ksp(CoC2O4)=4.0×10-6 , 求常温下Co2+与草酸反应生成CoC2O4沉淀的平衡常数K=。(5)、高温下,在O2存在时,纯净的CoC2O4与Li2CO3再生为LiCoO2的化学方程式为。(6)、在空气中煅烧CoC2O4生成钴的氧化物和CO2 , 若测得充分煅烧后固体的质量为3.615g,CO2的体积为2.016L(标准状况),则钴的氧化物的化学式为。10. 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:(1)、向碘水中加入四氯化碳后充分振荡,静置后的现象是。(2)、①已知反应H2(g)+I2(g)=2HI(g),该反应中相关化学键的键能数据如表所示:共价键
H-H
I-I
H-I
键能/kJ·mol−1
436
151
299
则该反应的ΔH=kJ·mol−1。
②下列叙述能说明上述反应已达到平衡的是。
a.单位时间内生成nmolH2 , 同时生成nmolHI
b.温度和体积一定时,HI浓度不再变化
c.温度和体积一定时,混合气体颜色不再变化
d.温度和压强一定时,混合气体的密度不再变化
(3)、NaHSO3溶液在不同温度下均可被过量KIO3(IO 被还原成I-)氧化,当NaHSO3完全消耗即有I2析出,写出I2析出时发生反应的离子方程式:。依据I2析出所需时间可以求得NaHSO3的反应速率,将浓度均为0.020mol·L-1NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。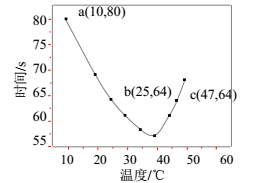
图中a点对应的NaHSO3反应速率为mol·L-1·s-1。b、c两点对应的NaHSO3反应速率v(b)v(c)(填“>”、“=”、“<”)。
(4)、在1L真空密闭容器中加入amolNH4I固体,t℃时发生如下反应:NH4I(s)=NH3(g)+HI(g)①
2NH3(g)=N2(g)+3H2(g)②
2HI(g)=I2(g)+H2(g)③
达平衡时,体系中n(HI)=bmol,n(I2)=cmol,n(H2)=dmol,则n(N2)=mol,t℃时反应①的平衡常数K值为 (用字母表示)。
11. Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:(1)、Co3+的价电子排布图为:;基态磷原子有种空间运动状态不同的电子。(2)、Li、O、P三种元素的电负性由大到小的顺序是:。(3)、写出一种与PO 互为等电子体的分子的化学式: , 该分子的中心原子的价层电子对数等于。(4)、已知无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有:。A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(5)、N和P是同主族元素,但是NH3分子中的键角大于PH3分子中的键角,原因是:。(6)、Li2O为离子晶体,具有反萤石结构,晶胞如下图所示。则O2-配位数为: , 若晶胞参数为bnm,阿伏加德罗常数的值为NA , 则Li2O的密度为g·cm-3(列出计算式即可),O2-和Li+的最短距离等于nm(用含b的代数式表示)。 12. 奴佛卡因是口腔科局麻用药,某兴趣小组以甲苯和乙烯为主要原料,采用以下合成路线进行制备。
12. 奴佛卡因是口腔科局麻用药,某兴趣小组以甲苯和乙烯为主要原料,采用以下合成路线进行制备。 已知:苯环上有羧基时,新引入的取代基连在苯环的间位。
已知:苯环上有羧基时,新引入的取代基连在苯环的间位。请回答下列问题:
(1)、B的名称 , C中官能团的名称。(2)、F的结构简式 , 反应⑤的反应条件。(3)、下列有关反应的说法正确的是: 。(填标号)A、步骤①和②可以互换; B、1 mol H物质最多和4 mol氢气发生加成反应; C、步骤①→⑤共有2个取代反应; D、E中所有原子处于同一平面。(4)、写出A→B的反应方程式。(5)、写出两种同时符合下列条件的B的同分异构体、。①红外光谱检测分子中含有醛基;
②1H-NMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子。
(6)、参照上述路线,写出以苯和 为原料制取的合成
为原料制取的合成  路线图。
路线图。