安徽省黄山市2021年高考化学二模试卷
试卷更新日期:2021-05-24 类型:高考模拟
一、单选题
-
1. 化学与生活息息相关,下列说法错误的是( )A、“84消毒液”的主要有效成分是NaClO,NaClO通过氧化灭活病毒 B、铁粉和氧化铝发生的铝热反应可用于焊接铁轨 C、疫苗一般应冷藏存放,以避免蛋白质变性 D、“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味”文中的“气”是指乙烯2. 天然气是应用广泛的燃料,但含有少量的H2S气体。在酸性溶液中利用硫杆菌可实现天然气的脱硫,其原理如图所示,下列说法正确的是( )
 A、过程甲中的离子方程式为: B、FeSO4为该脱硫过程的催化剂 C、过程乙中每4molFe2+参加反应,需消耗22.4L的O2 D、脱硫过程中O2间接氧化H2S3. 紫花前胡醇
A、过程甲中的离子方程式为: B、FeSO4为该脱硫过程的催化剂 C、过程乙中每4molFe2+参加反应,需消耗22.4L的O2 D、脱硫过程中O2间接氧化H2S3. 紫花前胡醇 可从中药材当归 和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是( ) A、1mol该有机物最多能与5molH2反应 B、能够与钠反应生成氢气 C、能使溴水或酸性高锰酸钾溶液褪色 D、能够发生水解反应4. 下列实验操作或相关说法合理的是( )
可从中药材当归 和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是( ) A、1mol该有机物最多能与5molH2反应 B、能够与钠反应生成氢气 C、能使溴水或酸性高锰酸钾溶液褪色 D、能够发生水解反应4. 下列实验操作或相关说法合理的是( )A
B
C
D



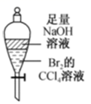
混合浓硫酸和乙醇
验证SO2的漂白性
蒸干MgCl2溶液制取无水MgCl2
充分振荡后下层为无色
A、A B、B C、C D、D5. 已知W、X、Y、Z为原子序数依次增大的短周期主族元素,W与X、Y、Z均能形成10电子分子,其中Y的最简单的氢化物易与其最高价氧化物对应的水化物反应生成化合物甲,W、X、Y、Z可以形成化合物乙(结构如图),下列说法正确的是( ) A、W不能和X、Y形成18电子的化合物 B、甲中含有离子键和非极性共价键 C、原子半径:X>Y>Z>W D、W与X形成的化合物的沸点一定低于W与Z所形成的化合物6. 镍镉电池是二次电池,其工作原理如图(L为小灯泡,K1、K2为开关,a、b为直流电源的两极)。下列说法错误的是( )
A、W不能和X、Y形成18电子的化合物 B、甲中含有离子键和非极性共价键 C、原子半径:X>Y>Z>W D、W与X形成的化合物的沸点一定低于W与Z所形成的化合物6. 镍镉电池是二次电池,其工作原理如图(L为小灯泡,K1、K2为开关,a、b为直流电源的两极)。下列说法错误的是( ) A、断开K2、合上K1 , 电极A的电势低于电极B B、断开K1、合上K2 , 电极A为阴极,发生氧化反应 C、电极B发生还原反应过程中,溶液中的KOH浓度有变化 D、镍镉二次电池的总反应式: Cd(OH)2+2Ni(OH)2 Cd+2NiOOH+2H2O7. 25℃时,若某混合溶液中始终保持 , , 、 和 随pH变化的关系如下图所示。Ka为CH3COOH的电离常数,下列说法正确的是( )
A、断开K2、合上K1 , 电极A的电势低于电极B B、断开K1、合上K2 , 电极A为阴极,发生氧化反应 C、电极B发生还原反应过程中,溶液中的KOH浓度有变化 D、镍镉二次电池的总反应式: Cd(OH)2+2Ni(OH)2 Cd+2NiOOH+2H2O7. 25℃时,若某混合溶液中始终保持 , , 、 和 随pH变化的关系如下图所示。Ka为CH3COOH的电离常数,下列说法正确的是( ) A、M点时, B、N点时,pH=lgKa C、该体系中, D、O点和P点比较,溶液中P点 的值更大
A、M点时, B、N点时,pH=lgKa C、该体系中, D、O点和P点比较,溶液中P点 的值更大二、综合题
-
8. CuCl是有机合成工业中应用较广的催化剂,是一种白色粉末,微溶于水,不溶于稀硫酸和乙醇;在潮湿的空气中易水解氧化为碱式氯化铜。工业上用黄铜矿(主要成分是 CuFeS2 , 还含有少量SiO2)制备CuCl的工艺流程如下:

回答下列问题:
(1)、为了提高矿砂浸取率,可以(任答两种)。(2)、“浸取”时NO 中N元素主要被还原为最低价态,则反应的离子方程式为。(3)、“滤渣①”的成分为SiO2、S;“滤渣②”的成分是 (填化学式)。(4)、已知在水溶液中存在平衡: (无色)。“还原”中所发生反应的离子方程式为 , 当出现现象时,表明“还原”进行完全。(5)、“一系列操作”是指加入去氧水、过滤、用无水乙醇洗涤、真空干燥,加去氧水的目的 。(6)、准确称取所制备的氯化亚铜产品mg,将其置于过量的FeCl3 溶液中,待样品完全溶解后,加入适量稀硫酸,用amol∙L-1的K2Cr2O7溶液滴定到终点(滴定过程中Cl-不参加反应),消耗K2Cr2O7溶液bmL,反应中Cr2O 被还原为Cr3+ ,产品中CuCl的纯度为。9. 乙酰苯胺( )在工业上作磺胺类药物原料等,可通过苯胺和乙酸反应制得:
)在工业上作磺胺类药物原料等,可通过苯胺和乙酸反应制得: 已知:纯乙酰苯胺是白色片状晶体,熔点为114℃;微溶于冷水,可溶于热水,易溶于有机溶剂;加热时易被氧化。
实验室制备乙酰苯胺的步骤如下(部分装置省略):
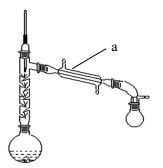
Ⅰ.粗乙酰苯胺的制备
在150mL 烧瓶中加入15mL(过量)乙酸(沸点117.9℃)、少量Zn粉和10mL(0.11mol)新制得的苯胺,如图接好装置。在石棉网上用小火加热,控制顶端馏出温度105℃左右使之充分反应1h。待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有250mL冷水的烧杯中,乙酰苯胺晶体析出。充分冷却至室温后,减压过滤,用洗涤晶体2~3次。用滤液冲洗烧杯上残留的晶体,再次过滤,两次过滤得到的固体合并在一起。
Ⅱ.乙酰苯胺的提纯
将上述制得的粗乙酰苯胺固体移入500mL烧杯中,加入100mL热水,加热至沸腾,待粗乙酰苯胺完全溶解后,再补加少量蒸馏水。稍冷后,加入少量活性炭吸附色素等杂质,在搅拌下微沸5min,趁热过滤。待滤液冷却至室温,有晶体析出,称量产品为11.2g。
回答下列问题:
(1)、仪器a的名称是。(2)、加入锌粉的目的是。反应中加入锌粉的量不宜过多,试从平衡的角度分析原因为。(3)、步骤Ⅰ控制馏出温度105℃的理由。洗涤晶体宜选用(填字母)。A.乙醇 B.CCl4 C.冷水 D.乙醚
(4)、步骤Ⅱ中,粗乙酰苯胺溶解后,补加少量蒸馏水的目的是。(5)、步骤Ⅱ中,称量前的操作是。上述提纯乙酰苯胺的方法叫。(6)、乙酰苯胺的产率为。(计算结果保留3位有效数字)10. 氮氧化物发生的反应是讨论化学平衡问题的常用体系。回答下列问题:(1)、①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH1②2NH3(g)+2O2(g)=N2O(g)+3H2O(g) ΔH2
③2N2O (g)=N2O(g)+ O2(g) ΔH3
上述反应ΔH1、ΔH2、ΔH3之间的关系式为ΔH3= 。
(2)、恒压条件下,NO和O2的起始浓度一定、催化反应时间相同,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。
①图中X点所示条件下,反应 达到平衡(填“已经”或“未”)。
②2NO(g)+O2(g) ⇌2NO2(g) ΔH0(填“>”或“<”)。
(3)、对于反应2NO+O2 ⇌2NO2 , 有人提出如下反应历程:第一步 2NO⇌N2O2 快速平衡
第二步 N2O2+O2→2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是______ (填标号)
A、v(第一步的逆反应)<v(第二步反应) B、N2O2是反应的中间产物 C、第二步反应活化能较高 D、第二步中N2O2与O2的每一次碰撞均是有效碰撞(4)、已知:N2O4(g) ⇌2NO2(g) ΔH>0。298K时,将一定量N2O4气体充入恒容的密闭容器中发生反应。①t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为25%,则NO2分压为 , (分压=总压×物质的量分数),反应N2O4(g) ⇌2NO2(g)的平衡常数Kx= (对于气相反应,用某组分B的物质的量分数x(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kx)。
②若提高反应温度至315K,且在恒压情况下反应达到平衡,则N2O4气体的平衡转化率25%(填“>”“=”“<”),原因是 。
11. 我国的超级钢研究已居于世界领先地位,这种超级钢中含Mn10%、C0.47%、Al2%、V0.7%,其强度很大,在应用时能够实现钢板的轻薄化。回答下列问题:(1)、基态Mn原子和V原子未成对电子数之比为。(2)、下列状态的铝中,电离最外层一个电子所需能量最大的是___________。A、[Ne]3s2 B、[Ne]3s23p1 C、[Ne]3s24s1 D、[Ne]3s1(3)、NH3的VSEPR模型的名称是 , 写出一种和NH3互为等电子体的阳离子的化学式。分子中的大π键可用符号∏ 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为∏ ),则平面分子 中的大π键应表示为。 (4)、谷氨酸(HOOC-CH(NH2)-CH2-CH2-COOH)的钠盐-谷氨酸钠(C5H8NO4Na)是味精的主要成分,谷氨酸分子中C原子的杂化方式为 , C原子与O原子所形成的化学键中σ键与π键的数目比n(σ)∶n(π)= , π键的特征是两块电子云呈对称。(5)、Al2O3、N2、CO的沸点从高到低的顺序为。原因是 。(6)、已知NaAlH4晶胞结构如图所示,它由两个正六面体叠加而成,Na+的配位数为。已知正六面体的棱长anm,NA为阿伏加德罗常数的值,则NaAlH4晶体的密度是 g• cm-3 (列出计算式)。
中的大π键应表示为。 (4)、谷氨酸(HOOC-CH(NH2)-CH2-CH2-COOH)的钠盐-谷氨酸钠(C5H8NO4Na)是味精的主要成分,谷氨酸分子中C原子的杂化方式为 , C原子与O原子所形成的化学键中σ键与π键的数目比n(σ)∶n(π)= , π键的特征是两块电子云呈对称。(5)、Al2O3、N2、CO的沸点从高到低的顺序为。原因是 。(6)、已知NaAlH4晶胞结构如图所示,它由两个正六面体叠加而成,Na+的配位数为。已知正六面体的棱长anm,NA为阿伏加德罗常数的值,则NaAlH4晶体的密度是 g• cm-3 (列出计算式)。 12. 有机物J可用于治疗心血管、高血压。以烃A为起始原料制备J合成路线如下:
12. 有机物J可用于治疗心血管、高血压。以烃A为起始原料制备J合成路线如下:
已知:①RX RCN RCOOH
②
 +R1-NH-R2
+R1-NH-R2  (1)、A的化学名称为 , 反应①的试剂与反应条件是。(2)、G中除
(1)、A的化学名称为 , 反应①的试剂与反应条件是。(2)、G中除 外的官能团名称为。 (3)、反应④的化学方程式。(4)、反应⑦的反应类型是 , I的结构简式为。(5)、M是E的同分异构体,为苯的二取代物,含酯基,可发生银镜反应,M共有种,其中核磁共振氢谱有四组峰,峰面积之比为1:2:2:2的结构简式为(任写一种)(6)、已知:
外的官能团名称为。 (3)、反应④的化学方程式。(4)、反应⑦的反应类型是 , I的结构简式为。(5)、M是E的同分异构体,为苯的二取代物,含酯基,可发生银镜反应,M共有种,其中核磁共振氢谱有四组峰,峰面积之比为1:2:2:2的结构简式为(任写一种)(6)、已知:
 结合题给信息和已学知识,设计由
结合题给信息和已学知识,设计由  为原料制备
为原料制备  的合成路线。(无机试剂任选)
的合成路线。(无机试剂任选)