黑龙江省双鸭山一高2020-2021学年高一下学期化学期中考试试卷
试卷更新日期:2021-05-24 类型:期中考试
一、选择题(每题只有一个正确答案,1—20题每题2分,21—25题每题3分,共55分)
-
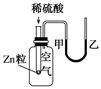
1. 材料是人类赖以生存和发展的物质基础。下列有关物质的说法正确的是( )A、石英玻璃、碳化硅陶瓷、水泥、石墨烯都是新型无机非金属材料 B、晶体硅的主要用途是制造光导纤维 C、汽车中小摆件“苹果花”的动力是以Si为原料制作的太阳能电池 D、普通玻璃的主要成分为纯碱、石灰石、石英砂2. 如图是某同学学习原电池后整理的学习笔记,错误的是( )
 A、①电子流动方向 B、②电流方向 C、③电极反应 D、④溶液中离子移动方向3. 下列叙述正确的是( )A、浓硫酸是一种干燥剂,不能用来干燥SO2气体 B、在蔗糖中加入浓硫酸后搅拌,蔗糖变黑、体积膨胀、并放出有刺激性气味的气体,只体现了浓硫酸的脱水性 C、把足量铜粉投入含2molH2SO4的浓硫酸中,反应后得到标准状况下气体体积为22.4L D、硫酸与铁反应时,生成物与反应条件、酸的浓度、反应物的用量等有关4. 如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是( )
A、①电子流动方向 B、②电流方向 C、③电极反应 D、④溶液中离子移动方向3. 下列叙述正确的是( )A、浓硫酸是一种干燥剂,不能用来干燥SO2气体 B、在蔗糖中加入浓硫酸后搅拌,蔗糖变黑、体积膨胀、并放出有刺激性气味的气体,只体现了浓硫酸的脱水性 C、把足量铜粉投入含2molH2SO4的浓硫酸中,反应后得到标准状况下气体体积为22.4L D、硫酸与铁反应时,生成物与反应条件、酸的浓度、反应物的用量等有关4. 如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是( )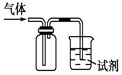
选项
试剂
现象
结论
A
酸性KMnO4溶液
溶液褪色
SO2有氧化性
B
品红溶液
溶液褪色
SO2有漂白性
C
NaOH溶液
无明显现象
SO2与NaOH溶液不反应
D
硫化氢水溶液
溶液变浑浊
SO2有还原性
A、A B、B C、C D、D5. 下列反应中硝酸既表现出酸性又表现出氧化性的是( )A、使石蕊溶液变红 B、与铜反应放出NO气体,生成Cu(NO3)2 C、与Na2CO3反应放出CO2气体,生成NaNO3 D、与S单质混合共热时生成H2SO4和NO26. 下列关于氮及其化合物的说法正确的是( )A、NO 和 NO2均可用排空气法收集 B、NH3的喷泉实验说明氨气极易溶于水 C、铵盐受热均易分解且一定有氨气生成 D、氨的催化氧化属于人工固氮7. 下列各组物质进行反应(表内物质均为反应物),反应刚开始时,放出H2的速率最快的是( )选项
金属(粉末状)
酸及其浓度
酸的体积/mL
反应起始温度/℃
A
0.1 mol Zn
6 mol·L-1硝酸
10
50
B
0.1 mol Fe
3 mol·L-1硫酸
20
30
C
0.1 mol Zn
3 mol·L-1硫酸
10
30
D
0.1 mol Zn
3 mol·L-1盐酸
40
30
A、A B、B C、C D、D8. 有a、b、c、d四种金属,将a与b用导线连接起来,浸入稀硫酸中,电极反应式之一为a-2e-=a2+;将a、d分别投入等浓度的盐酸中,d比a反应剧烈;又知一定条件下能发生如下离子反应:c2+ + b = b2+ + c,则四种金属的活动性由强到弱的顺序是( )A、dcab B、dabc C、dbac D、badc9. 下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )选项
A
B
C
D
反应装置或图像
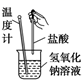
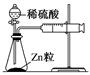
实验现象或图像信息
温度计的水银柱上升
反应物总能量大于生成物总能量
反应开始后,针筒活塞向右移动
反应开始后,甲处液面低于乙处液面
A、A B、B C、C D、D10. 已知反应A+B=C+D的能量变化如图所示,能量下列说法正确的是( )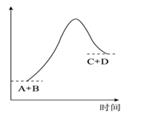 A、该反应为吸热反应 B、该反应只有在加热条件下才能进行 C、反应物的总能量高于产物的总能量 D、形成产物C和D的化学键所放出的总能量高于断开反应物A和B的化学键所吸收的总能量11. 下列装置能达到实验目的的是( )
A、该反应为吸热反应 B、该反应只有在加热条件下才能进行 C、反应物的总能量高于产物的总能量 D、形成产物C和D的化学键所放出的总能量高于断开反应物A和B的化学键所吸收的总能量11. 下列装置能达到实验目的的是( )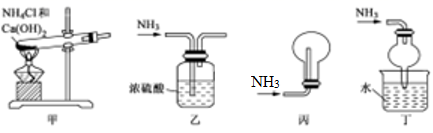 A、用装置甲制备氨气 B、用装置乙除去氨气中少量水 C、用装置丙收集氨气 D、用装置丁吸收多余的氨气12. 下列溶液中,不能鉴别CO2、SO2气体的是( )
A、用装置甲制备氨气 B、用装置乙除去氨气中少量水 C、用装置丙收集氨气 D、用装置丁吸收多余的氨气12. 下列溶液中,不能鉴别CO2、SO2气体的是( )①石灰水 ②H2S水溶液 ③酸性KMnO4溶液 ④碘和淀粉的混合物 ⑤氯水
⑥品红溶液
A、①⑤ B、②③④⑤⑥ C、只有① D、③④13. 将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是( )A、SO2和H2S B、Cl2和CO2 C、NH3和CO2 D、SO2和Cl214. CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如下图所示。下列结论不正确的是( )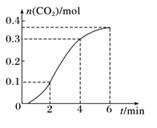 A、反应开始4 min内温度对反应速率的影响比浓度大 B、一段时间后,反应速率减小的原因是c(H+)减小 C、反应在2~4 min内平均反应速率最大 D、反应在1min末生成CO2的反应速率为v(CO2)=0.05 mol·L-1·min-1。15. 下列变化的实质相似的是( )
A、反应开始4 min内温度对反应速率的影响比浓度大 B、一段时间后,反应速率减小的原因是c(H+)减小 C、反应在2~4 min内平均反应速率最大 D、反应在1min末生成CO2的反应速率为v(CO2)=0.05 mol·L-1·min-1。15. 下列变化的实质相似的是( )①浓硫酸和浓硝酸在空气中敞口放置时浓度均减小
②二氧化硫和氯气均能使品红溶液褪色
③双氧水和活性炭使色素褪色
④氨气和碘化氢气体均不能用浓硫酸干燥
⑤常温下浓硫酸用铁制容器存放、浓硝酸能用铝罐车运输
⑥浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字
⑦二氧化碳、二氧化硫使澄清石灰水变浑浊
A、只有②④⑤ B、只有⑤⑦ C、只有③④⑥⑦ D、全部16. 下列对某溶液所含离子的检验,叙述正确的是( )A、滴BaCl2溶液和稀硝酸,产生白色沉淀,则原溶液中一定含有SO42- B、滴入盐酸酸化,再滴入硝酸银溶液,产生白色沉淀,则原溶液中一定含有Cl- C、滴入NaOH溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体,则原溶液中一定含有NH4+ D、滴入KSCN溶液无明显现象,再通入少量Cl2后呈红色,则原溶液中一定含有Fe2+17. 在给定条件下,下列选项所示的物质间转化均能一步实现的是( )A、 B、 C、 → Cu D、18. 某华人科学家和他的团队研发出“纸电池”(如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是( ) A、该电池的正极材料为锌 B、该电池反应中二氧化锰发生氧化反应 C、电池的正极反应式为MnO2+H2O+e-=MnO(OH)+OH- D、当有0.1 mol锌溶解时,流经电解液的电子数为1.204×102319. 某实验小组利用如图装置制备NH3并探究其性质。下列说法正确的是( )
A、该电池的正极材料为锌 B、该电池反应中二氧化锰发生氧化反应 C、电池的正极反应式为MnO2+H2O+e-=MnO(OH)+OH- D、当有0.1 mol锌溶解时,流经电解液的电子数为1.204×102319. 某实验小组利用如图装置制备NH3并探究其性质。下列说法正确的是( )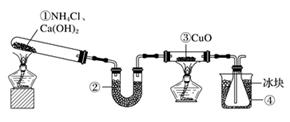 A、①中固体可换为NH4Cl B、②中药品为P2O5 C、反应一段时间后,③中黑色固体变为红色 D、反应一段时间后,④中锥形瓶收集到液氨20. 反应C(s)+ H2O(g) CO(g)+ H2(g)在密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A、①中固体可换为NH4Cl B、②中药品为P2O5 C、反应一段时间后,③中黑色固体变为红色 D、反应一段时间后,④中锥形瓶收集到液氨20. 反应C(s)+ H2O(g) CO(g)+ H2(g)在密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )①升温 ②增加C的量 ③将容器的体积缩小一半 ④保持体积不变,充入He使体系压强增大 ⑤保持压强不变,充入He ⑥保持体积不变,充入水蒸气使体系压强增大
A、①④ B、②③ C、③④ D、②④21. 汽车的启动电源常用铅酸蓄电池,该电池在放电时的总反应方程式为PbO2(s)+Pb(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l),根据此反应判断下列叙述正确的是( )A、PbO2是电池的负极,发生氧化反应 B、负极的电极反应式为Pb -2e- + SO42- = PbSO4 C、铅酸蓄电池放电时,溶液的酸性增强,每转移2 mol电子消耗2 mol H2SO4 D、电池放电时,两电极质量均增加,且每转移1 mol电子时正极质量增加48 g22. 已知:N2(g)+O2(g) 2NO(g)反应完1moLN2吸收的能量为181.5kJ。某科研小组尝试利用固体表面催化工艺进行NO的分解。若用 和
和  分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是( )
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是( ) 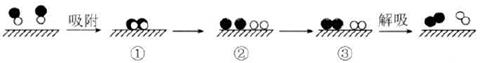 A、① B、② C、③ D、无法确定23. 按图进行实验。试管中装有12 mL NO,然后间歇而又缓慢地通入8 mL O2 , 下列是有关最终状态的描述:
A、① B、② C、③ D、无法确定23. 按图进行实验。试管中装有12 mL NO,然后间歇而又缓慢地通入8 mL O2 , 下列是有关最终状态的描述: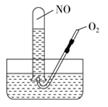
①试管内气体呈棕色 ②试管内气体呈无色 ③试管内液面不变
④试管内液面上升 ⑤试管内气体是O2
⑥试管内气体是NO。其中正确的是( )
A、①③ B、②④⑤ C、②④⑥ D、②③⑤24. 无色的混合气体甲,可能含有NO、CO2、 NO2、NH3、N2中的某几种。将100mL气体经过如下图的实验处理,结果得到酸性溶液,而几乎无气体剩余。则甲气体的组成为( ) A、NH3、NO2、N2 B、NH3、NO2、CO2 C、NH3、NO、CO2 D、NO、CO2、N225. 足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )A、60mL B、45mL C、30mL D、无法计算
A、NH3、NO2、N2 B、NH3、NO2、CO2 C、NH3、NO、CO2 D、NO、CO2、N225. 足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )A、60mL B、45mL C、30mL D、无法计算二、填空题(共45分)
-
26. 如图表示A、B、C、D、E五种含氮物质相互转化的关系。其中A、B、C、D常温下都是气体,B为红棕色,写出A、B、C、D、E的化学式和各步反应的化学方程式。
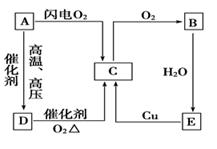 (1)、除去C中的B所用的试剂为(2)、写出A的电子式(3)、检验试管中盛装的是D的方法为(4)、E→C的离子方程式(5)、写出实验室制备D的化学方程式27. 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(1)、除去C中的B所用的试剂为(2)、写出A的电子式(3)、检验试管中盛装的是D的方法为(4)、E→C的离子方程式(5)、写出实验室制备D的化学方程式27. 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题: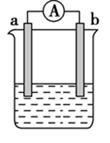 (1)、当电极a为Zn,电极b为Cu,且两极板质量相等。电解质溶液为CuSO4溶液时,正极的电极反应式为。当电路中有1moL e- 通过时,两极板的质量差为g(2)、当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该电池的负极反应式为。当反应中收集到标准状况下336mL气体时,消耗的电极的物质的量为moL。(3)、燃料电池的工作原理是将燃料和氧化剂如O2)反应所产生的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,CO为燃料,采用氢氧化钠溶液为电解液,则CO应通入极填“a”或“b”,该电极反应式为 , 电解质溶液中OH-向极移动(填“a”或“b”)。(4)、理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Fe + 2Fe3+=3Fe2+”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液。
(1)、当电极a为Zn,电极b为Cu,且两极板质量相等。电解质溶液为CuSO4溶液时,正极的电极反应式为。当电路中有1moL e- 通过时,两极板的质量差为g(2)、当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该电池的负极反应式为。当反应中收集到标准状况下336mL气体时,消耗的电极的物质的量为moL。(3)、燃料电池的工作原理是将燃料和氧化剂如O2)反应所产生的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,CO为燃料,采用氢氧化钠溶液为电解液,则CO应通入极填“a”或“b”,该电极反应式为 , 电解质溶液中OH-向极移动(填“a”或“b”)。(4)、理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Fe + 2Fe3+=3Fe2+”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液。 28.(1)、Ⅰ﹒在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g) 3C(g)+nD(g),开始时A为4 mol,B为6 mol,5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。
28.(1)、Ⅰ﹒在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g) 3C(g)+nD(g),开始时A为4 mol,B为6 mol,5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。计算:
5 min末A的物质的量浓度为 , A的转化率为。
(2)、前5 min内用B表示的化学反应速率v(B)为。(3)、化学方程式中n=。(4)、此反应在四种不同情况下的反应速率分别为:①v(A)=5 mol·L-1·min-1 ②v(B)=6 mol·L-1·min-1
③v(C)=0.2 mol·L-1·s-1 ④v(D)=8 mol·L-1·min-1
其中反应速率最快的是(填序号)。
(5)、Ⅱ. H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。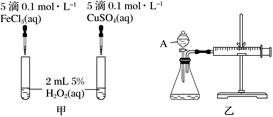
若利用图甲装置,可通过观察现象,从而定性比较得出结论。
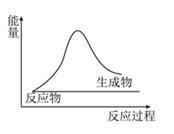
(6)、有同学提出将0.1 mol·L-1 FeCl3改为mol·L-1 Fe2(SO4)3更为合理,其理由是。(7)、若利用乙实验可进行定量分析,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是。(8)、将0.1 mol MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示解释反应速率变化的原因:。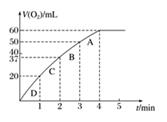 29.(1)、Ⅰ.下列过程中的能量变化符合图示的是
29.(1)、Ⅰ.下列过程中的能量变化符合图示的是①铝片和稀盐酸的反应;②Ba(OH)·8H2O和NH4Cl反应;
③甲烷在氧气中燃烧;④将胆矾加热变为白色粉末;⑤酸碱中和反应;
⑥碘的升华;⑦NaOH固体溶于水;⑧氢气还原氧化铜
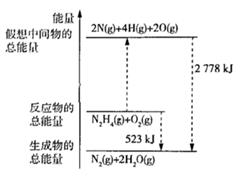 (2)、Ⅱ.断裂 化学键所需要的能量如表所示,腓( )的有关化学反应的能量变化如图所示。
(2)、Ⅱ.断裂 化学键所需要的能量如表所示,腓( )的有关化学反应的能量变化如图所示。化学键
氧氧键
能量/( )
a
498
946
391
回答下列问题:
①( 与 反应生成 和 放出的能量为 。
② 与 断键吸收的能量为 。
③ 。
④当有 (l)生成时,放出的能量(填“>”“<”或“=”) 523kJ.
(3)、Ⅲ﹒用 生产某些含氯有机物时会产生副产物 。利用反应A可实现氯元素的循环使用。反应A:
已知:①.反应A中 被氧化,放出 的热量。
②.

断开 键与断开 键所需能量相差 。水分子中H-O键比氯化氢分子中H-Cl键(填“强”或“弱”)。