江苏省扬州市江都区2021年中考化学一模试卷
试卷更新日期:2021-05-21 类型:中考模拟
一、单选题
-
1. 防治大气污染、打赢蓝天保卫战。下列做法不应该提倡的是( )A、开发使用清洁能源 B、田间焚烧作物秸秆 C、积极鼓励植树造林 D、养成低碳生活习惯2. 下列变化属于物理变化的是( )A、钢铁锈蚀 B、电解水 C、干冰升华 D、蛋白质变性3. 下列物质由分子构成的是( )A、二氧化硅 B、铁 C、氯化钠 D、水4. 碳酸钠(Na2CO3)是生产管道疏通剂的原料之一,碳酸钠属于( )A、单质 B、氧化物 C、碱 D、盐5. 下列化学用语书写正确的是( )A、2 个氢原子:H2 B、氧气:O2 C、镁离子:Mg+2 D、碳酸:6. 国家标准中对洗手液 pH 的要求在 4~10 之间,下表是几种市售普通洗手液的测定 pH,其中酸性最强的是( )
品牌
开米洗手液
必速洗手液
舒肤佳洗手液
蓝月亮洗手液
pH (25℃)
7.46
6.22
4.55
4.21
A、开米洗手液 B、必速洗手液 C、舒肤佳洗手液 D、蓝月亮洗手液7. 功能性洗手液常用 NH4Cl 作增稠剂,以延长洗手液在皮肤上的滞留时间,NH4Cl 中 N 元素的化合价为( )A、-3 B、0 C、+2 D、+38. 医用口罩内含“熔喷布”,能有效过滤空气中的非油性颗粒物,生产“熔喷布”的主要原料是聚丙烯[(C3H6)n],聚丙烯是由丙烯(C3H6)加聚而成。下列说法正确的是( ) A、丙烯的相对分子质量为 42g B、丙烯中有 3 个碳原子、6 个氢原子 C、聚丙烯是有机高分子化合物 D、聚丙烯中碳、氢元素的质量比为 3:69. 过氧乙酸是一种高效消毒剂,市售过氧乙酸 AB 液二元制剂混合后生成的过氧乙酸质量分数为 18%。现欲配制 90g 质量分数为 2%的过氧乙酸溶液用于喷雾消毒,需要 18%过氧乙酸溶液的质量为( )A、1.8 克 B、10 克 C、80 克 D、88.2 克10. 粗盐提纯实验包含称量,溶解、过滤和蒸发,下列装置和操作能达到实验目的的是( )A、量取10mL水
A、丙烯的相对分子质量为 42g B、丙烯中有 3 个碳原子、6 个氢原子 C、聚丙烯是有机高分子化合物 D、聚丙烯中碳、氢元素的质量比为 3:69. 过氧乙酸是一种高效消毒剂,市售过氧乙酸 AB 液二元制剂混合后生成的过氧乙酸质量分数为 18%。现欲配制 90g 质量分数为 2%的过氧乙酸溶液用于喷雾消毒,需要 18%过氧乙酸溶液的质量为( )A、1.8 克 B、10 克 C、80 克 D、88.2 克10. 粗盐提纯实验包含称量,溶解、过滤和蒸发,下列装置和操作能达到实验目的的是( )A、量取10mL水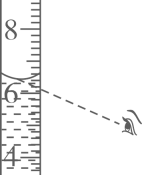 B、溶解粗盐
B、溶解粗盐 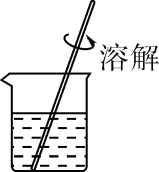 C、过滤悬浊液
C、过滤悬浊液  D、蒸发滤液
D、蒸发滤液 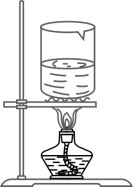 11. 下列化学方程式书写正确的是( )A、 B、 C、 D、12. 施用化肥可提高农作物产量,碳铵(NH4HCO3)属于( )A、氮肥 B、钾肥 C、磷肥 D、复合肥13. “垃圾分类工作就是新时尚”,废旧报纸应投入下列哪种标识的垃圾箱( )A、厨余垃圾
11. 下列化学方程式书写正确的是( )A、 B、 C、 D、12. 施用化肥可提高农作物产量,碳铵(NH4HCO3)属于( )A、氮肥 B、钾肥 C、磷肥 D、复合肥13. “垃圾分类工作就是新时尚”,废旧报纸应投入下列哪种标识的垃圾箱( )A、厨余垃圾 B、可回收物
B、可回收物  C、其他垃圾
C、其他垃圾  D、有害垃圾
D、有害垃圾  14. 生活中处处充满化学,下列说法错误的是( )A、保持铁制品表面干燥,可以防锈蚀 B、洗发水清洗头发上的油脂,有乳化作用 C、用聚氯乙烯塑料袋包装食品 D、回收废旧电池,可减少环境污染15. 宏观辨识与微观探析是化学学科的核心素养之一、下列微观解释不合理的是( )A、金刚石和石墨的物理性质差异很大 —— 碳原子排列方式不同 B、食盐溶液能导电而蔗糖溶液不能 —— 蔗糖在水溶液中没有能产生自由移动的离子 C、NaOH 溶液和稀盐酸正好完全反应后溶液呈中性 —— H+和 OH-结合成 H2O 分子 D、水结冰体积膨胀 —— 水分子体积变大16. KNO3与 NaCl 的溶解度曲线如图所示。下列说法正确的是( )
14. 生活中处处充满化学,下列说法错误的是( )A、保持铁制品表面干燥,可以防锈蚀 B、洗发水清洗头发上的油脂,有乳化作用 C、用聚氯乙烯塑料袋包装食品 D、回收废旧电池,可减少环境污染15. 宏观辨识与微观探析是化学学科的核心素养之一、下列微观解释不合理的是( )A、金刚石和石墨的物理性质差异很大 —— 碳原子排列方式不同 B、食盐溶液能导电而蔗糖溶液不能 —— 蔗糖在水溶液中没有能产生自由移动的离子 C、NaOH 溶液和稀盐酸正好完全反应后溶液呈中性 —— H+和 OH-结合成 H2O 分子 D、水结冰体积膨胀 —— 水分子体积变大16. KNO3与 NaCl 的溶解度曲线如图所示。下列说法正确的是( ) A、T1时,NaCl 的溶解度比 KNO3的大 B、T2时,KNO3与 NaCl 的饱和溶液中溶质质量相等 C、NaCl 的溶解度受温度影响的程度比 KNO3的大 D、提纯 KNO3和 NaCl 固体混合物中的 KNO3 , 可用蒸发溶剂结晶17. 以红土镍矿(主要含有 Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaxFey(SO4)2(OH)6]和纳米镍粉的部分工艺流程如下图所示。下列说法错误的是( )
A、T1时,NaCl 的溶解度比 KNO3的大 B、T2时,KNO3与 NaCl 的饱和溶液中溶质质量相等 C、NaCl 的溶解度受温度影响的程度比 KNO3的大 D、提纯 KNO3和 NaCl 固体混合物中的 KNO3 , 可用蒸发溶剂结晶17. 以红土镍矿(主要含有 Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaxFey(SO4)2(OH)6]和纳米镍粉的部分工艺流程如下图所示。下列说法错误的是( )
(资料卡片):黄钠铁矾受热分解会生成 Na2SO4、Fe2O3、SO2、H2O 和 O2.
A、“酸浸”时发生的反应之一为 B、“过滤 I”得到的滤渣要进行洗涤是为了除去滤渣表面可溶性杂质 C、纳米镍粉可用于制造镍氢电池,镍氢电池在工作时,将化学能转变为电能 D、将一定质量的黄钠铁矾加热使其完全分解,将所得固体物质溶于足量水,过滤、洗涤、烘干得到 9.60g 固体,将滤液蒸干得 2.84g 固体(不含结晶水),可推知x∶y = 1∶3二、多选题
-
18. 下列物质性质和用途的对应关系中,错误的是( )A、石墨质软,可作电极 B、氮气性质稳定,可作食品保护气 C、一氧化碳具有可燃性,可冶炼金属 D、活性炭具有吸附性,可吸附色素19. 在一定条件下,某反应的微观示意图如图,下列说法正确的是( )
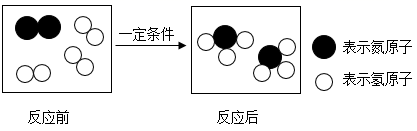 A、反应前后各元素化合价均不变 B、反应前后原子数目不变 C、反应中氮气和氢气的质量比是 1∶3 D、该反应属于化合反应20. 下列实验方案可行的是( )A、通过溶解,测定温度变化,可以鉴别 NaCl 和 NaOH 固体 B、通过溶解、过滤、洗涤、晾干等操作,可回收 KCl 和 MnO2 固体混合物中 KCl C、加热 KMnO4 制氧气,当水槽中导气管开始冒气泡时,就开始收集 D、将带火星的木条放在集气瓶瓶口,可检验 O2 是否收集满
A、反应前后各元素化合价均不变 B、反应前后原子数目不变 C、反应中氮气和氢气的质量比是 1∶3 D、该反应属于化合反应20. 下列实验方案可行的是( )A、通过溶解,测定温度变化,可以鉴别 NaCl 和 NaOH 固体 B、通过溶解、过滤、洗涤、晾干等操作,可回收 KCl 和 MnO2 固体混合物中 KCl C、加热 KMnO4 制氧气,当水槽中导气管开始冒气泡时,就开始收集 D、将带火星的木条放在集气瓶瓶口,可检验 O2 是否收集满三、填空题
-
21. 随着中国航天事业的快速发展,我们探索太空的脚步会迈得更大、更远。今明两年,我国载人航天工程预计实施 11 次发射任务。(来源:中央纪委国家监委网站)(1)、“长征五号 B”运载火箭发射空间站核心舱,火箭采用了液氧-煤油、液氧-液氢发动机,液氧-液氢发动机的工作原理是(填化学方程式),反应(填“放出”或“吸收”)热量。(2)、钛铝合金是制造高推重比航空发动机极具潜力的高温结构材料。下图是钛元素的信息及钛原子的结构示意图,钛原子中质子数为 , 钛原子的相对原子质量为 , 钛原子在化学变化中易(填“得到”或“失去”)电子。钛铝合金可能具有的特性有(填序号)。


A 质量轻 B 硬度大 C 抗变形 D 耐高温
(3)、我国“神舟”系列飞船返回舱使用的是玻璃钢蜂窝增强热防护材料,玻璃钢是材料 (填材料类别 )。(4)、“天宫二号”上的“迷你太空温室”完成了拟南芥(植物)从种子到种子的发育全过程的培养实验,植物在光照条件下进行作用,实现物质及能量的转换。(5)、“神舟十一”飞船为航天员提供了近百种食品,保证了航天员的营养需求。其中副食有土豆牛肉,下表是每 100g 土豆及牛肉中营养成分含量。(信息来自“食安通”网站)蛋白质/g
脂肪/g
糖类/g
磷/mg
钾/mg
铁/mg
锌/mg
硒/μg
维生素 C/mg
土豆
2.0
0.2
17.2
40
342
0.8
0.37
0.8
27
牛肉
19.9
4.2
2.0
168
216
3.3
4.73
6.4
0
①上表中的磷、钾、铁、锌是指 (填字母)。
A 原子 B 单质 C 元素
②上表中属于人体所需的微量元素有锌、硒及(填元素符号)。人体中缺少某些元素,会影响健康,缺(填元素符号)会使儿童发育停滞,智力低下。
②实验室检验淀粉的试剂是。淀粉在一定条件下可以和水发生反应转化为葡萄糖,葡萄糖的化学式是。
④牛肉含有的营养成分主要是。蛋白质在体内分解为小分子化合物。
22. 《天工开物》是我国明朝宋应星编写的一部综合性的科学技术著作,其中很多内容与化学知识有关。阅读下述文字片段,回答问题。(1)、“凡钢铁炼法,……火力到时,……取出加锤。”意为高温条件下,生铁中的碳和氧气反应生成 CO2 , 从而使生铁炼成钢,反应的化学方程式为。(2)、“每红铜六斤,入倭铅四斤,先后入罐熔化,冷定取出,即成黄铜。”指的是黄铜的熔炼过程,这里的倭铅是指 (填元素符号)。(3)、“火力到后,烧酥石性。急用者以水沃之,亦自解散。”意为 CaCO3 高温分解及 CaO 和 H2O 反应,对应的化学方程式分别为、。(4)、“烧铁器淬于胆矾水中,即成铜色也。”指的是铁和胆矾(CuSO4·5H2O)溶液的反应,该反应属于反应(填基本反应类型)。23. 电石渣是电石制取乙炔气体后的废渣,电石渣主要成分是 Ca(OH)2 , 另有少量 SiO2、FeO、Al2O3、MgO 等物质。电石渣可用于生产建材、化工产品,治理大气及废水污染处理等。某化工厂用电石渣湿法脱硫,除去烟气中的 SO2.回答问题: (1)、化工厂烟气中的 SO2排放到空气中,降雨时会造成酸雨,SO2和 H2O反应的化学方程式为。(2)、学习小组研究了不同 pH 条件下的脱硫效率,发现 pH 为 6.5 时,脱硫效率较好,测定 pH 时,应用测定。(3)、上图是湿法脱硫工艺中的喷淋塔局部示意图,SO2入口为(填“a”或“b”)。(4)、常用石灰石进行烟气脱硫,反应的原理是 。电石渣湿法脱硫过程中,Ca(OH)2与 SO2、O2、H2O 发生反应,生成 CaSO4·2H2O,反应的化学方程式为。湿法脱硫相比石灰石脱硫效率更 高的原因可能是 , 此外,电石渣湿法脱硫的优点除了以废治废,降低成本,还有。(5)、已知: ,某pH条件下,若SO2入口浓度为2000mg/m3 , 出口浓度为 30mg/m3 , 则此工艺条件下 SO2的脱除效率为 。
(1)、化工厂烟气中的 SO2排放到空气中,降雨时会造成酸雨,SO2和 H2O反应的化学方程式为。(2)、学习小组研究了不同 pH 条件下的脱硫效率,发现 pH 为 6.5 时,脱硫效率较好,测定 pH 时,应用测定。(3)、上图是湿法脱硫工艺中的喷淋塔局部示意图,SO2入口为(填“a”或“b”)。(4)、常用石灰石进行烟气脱硫,反应的原理是 。电石渣湿法脱硫过程中,Ca(OH)2与 SO2、O2、H2O 发生反应,生成 CaSO4·2H2O,反应的化学方程式为。湿法脱硫相比石灰石脱硫效率更 高的原因可能是 , 此外,电石渣湿法脱硫的优点除了以废治废,降低成本,还有。(5)、已知: ,某pH条件下,若SO2入口浓度为2000mg/m3 , 出口浓度为 30mg/m3 , 则此工艺条件下 SO2的脱除效率为 。四、实验题
-
24. 学习小组用石灰石和稀盐酸制取 CO2.(1)、实验室用石灰石和稀盐酸制取 CO2的化学方程式为。
 (2)、仪器 A、D 的名称分别为、。实验室制取 CO2的发生装置应选用的仪器为(填字母)。(3)、通常状况下,CO2密度比空气大,利用该性质可以用 法收集 CO2.欲除去 CO2中混有的水蒸气,可将混合气体通过盛有 (填试剂名称)的 F 装置,混合气体应从 (填“a”或“b”)管通入。(4)、学习小组利用不同溶质质量分数的盐酸制取 CO2 , 并测定了排水法中的 CO2收集率。分析下表数据可知:制取 CO2时,盐酸的质量分数最合适的是。
(2)、仪器 A、D 的名称分别为、。实验室制取 CO2的发生装置应选用的仪器为(填字母)。(3)、通常状况下,CO2密度比空气大,利用该性质可以用 法收集 CO2.欲除去 CO2中混有的水蒸气,可将混合气体通过盛有 (填试剂名称)的 F 装置,混合气体应从 (填“a”或“b”)管通入。(4)、学习小组利用不同溶质质量分数的盐酸制取 CO2 , 并测定了排水法中的 CO2收集率。分析下表数据可知:制取 CO2时,盐酸的质量分数最合适的是。盐酸质量分数/%
10%
7.5%
5%
石灰石形状
颗粒
块状
颗粒
块状
颗粒
块状
CO2收集率/%
65
58
79
79
66
40
五、流程题
-
25. 碳酸钙广泛应用于塑料、造纸、日化等行业,下图是用电石渣废渣制备纳米碳酸钙的工艺流程。回答问题。
(资料卡片):
①NH3极易溶于水,溶于水生成 NH3·H2O。
③电石渣浸取液碳化的反应化学方程式为: 。
 (1)、浸取时,电石渣中 Ca(OH)2和 NH4Cl 溶液反应的化学方程式为。(2)、操作Ⅰ的名称是 , 实验室完成此操作需要用到玻璃棒,其作用是 , 完成此操作所需的仪器有烧杯、漏斗、玻璃棒、。滤渣 A 含多种物质,其中一种为红褐色碱类,该物质是(填化学式)。(3)、“……”为一系列操作,包含过滤、洗涤及干燥。洗涤(蒸馏水洗涤)时,为检验产品是否洗净,最适合的检验试剂为。
(1)、浸取时,电石渣中 Ca(OH)2和 NH4Cl 溶液反应的化学方程式为。(2)、操作Ⅰ的名称是 , 实验室完成此操作需要用到玻璃棒,其作用是 , 完成此操作所需的仪器有烧杯、漏斗、玻璃棒、。滤渣 A 含多种物质,其中一种为红褐色碱类,该物质是(填化学式)。(3)、“……”为一系列操作,包含过滤、洗涤及干燥。洗涤(蒸馏水洗涤)时,为检验产品是否洗净,最适合的检验试剂为。A AgNO3溶液 B BaCl2溶液 C NaOH 溶液与湿润的红色石蕊试纸
(4)、生产中,浸取逸出的少量 NH3应该回收利用,此外,还可以循环使用的物质有。有 同学指出,“……”系列操作中过滤后的滤液及产品洗涤后的洗液不宜直接循环使用,结合下图分析,理由是 , 改进的方法是。从物质循环利用角度考虑,碳化时,可用代替 CO2.A NH4HCO3溶液 B Na2CO3溶液 C CO
 (5)、电石渣浸取时,最适合的浸取温度为 40℃,结合下图分析,理由是。
(5)、电石渣浸取时,最适合的浸取温度为 40℃,结合下图分析,理由是。 (6)、下图是电石渣浸取液碳化时的实验装置图,碳化时,需打开搅拌器搅拌,这既能搅拌反应液,还能 , 使碳化更充分。
(6)、下图是电石渣浸取液碳化时的实验装置图,碳化时,需打开搅拌器搅拌,这既能搅拌反应液,还能 , 使碳化更充分。 (7)、现有 10 吨电石渣,经测定其中 Ca(OH)2 含量为 90%,Ca2+的浸取率为 95%(假设电石渣中其他物质中不含钙元素,其他生产环节 Ca 元素无损失),则理论上可得多少吨纳米碳酸钙? (,写出计算过程,精确到小数点后 2 位) 。
(7)、现有 10 吨电石渣,经测定其中 Ca(OH)2 含量为 90%,Ca2+的浸取率为 95%(假设电石渣中其他物质中不含钙元素,其他生产环节 Ca 元素无损失),则理论上可得多少吨纳米碳酸钙? (,写出计算过程,精确到小数点后 2 位) 。
-